Прості речовини – ГАЛОГЕНИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ГАЛОГЕНИ
Прості речовини
Хімічні властивості простих речовин
Прості речовини галогенів являють собою двохатомні молекули. У молекулі атоми з’єднані одинарним ковалентним неполярним зв’язком.
Хімічні властивості Фтору
Фтор – найсильніший окисник у природі. Безпосередньо він не реагує тільки з гелієм, неоном та аргоном.
Під час реакції з металами утворюються фториди, сполуки іонного типу:
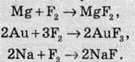
Фтор енергійно реагує з багатьма неметалами, навіть із деякими інертними газами:
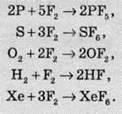
Фтор реагує навіть із багатьма хімічно стійкими сполуками, наприклад зі склом (у вигляді скловати):

Дуже багато органічних сполук в атмосфері фтору займаються, тобто починають горіти. Наприклад, деревина згорає, не залишаючи після себе навіть вугілля:
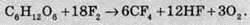
Вода теж горить у фторі:
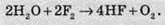
Фізичні властивості простих речовин
Властивості | Фтор | Хлор | Бром | Йод |
Формула | F2 | Cl2 | Вr2 | I2 |
Зовнішній вигляд у звичайних умовах | Газ | Газ | Рідина | Тверда речовина |
Колір | Яскраво-жовтий з жовтогарячим відтінком | Жовто-зелений | Колір брому між темно-червоним та бурим | Твердий йод – сіра кристалічна речовина з металічним блиском, а його пари – фіолетові |
Запах та смак | Різкий задушливий запах | Характерний задушливий запах (надає запаху хлорному вапну) | Дуже неприємний запах | Характерний запах “настоянки йоду” |
Температура плавлення | -220 °С | -102 °С | -7 °С | +114 °С (сублімується) |
Температура кипіння | -188 °С | -34 °С | +59 °С | +185 °С |
Густина при н. у. | 1,7 г/л | 3,214 г/л | 3,18 г/см3 | 4,94 г/см3 |
Розчинність у воді | В атмосфері фтору вода займається | 2,3 об’єму хлору розчиняється в 1 об’ємі води | 36 г в 1 літрі води | 0,3 г в 1 літрі води |
Хімічні властивості Хлору. Взаємодія з металами та неметалами
У більшості сполук, утворених атомом Хлору, він проявляє ступінь окиснення -1. Позитивний ступінь окиснення проявляється тільки в сполуках з такими атомами, як Флуор та Оксиген.
Проста речовина хлор взаємодіє з усіма металами. Під час цієї взаємодії метали окислюються до вищих ступенів. При цьому утворюються хлориди, сполуки Хлору з елементами, в яких атом Хлору проявляє ступінь окиснення -1:
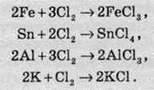
Хлор також активно реагує з усіма неметалами, за винятком азоту, кисню та інертних газів. У цьому разі так само утворюються хлориди:
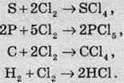
Хімічні властивості Хлору. Взаємодія зі складними речовинами
Хлор є більш сильним окисником, аніж бром чи йод, тому хлор витісняє важкі галогени з їхніх солей:
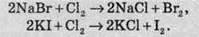
Розчиняючись у воді, хлор частково реагує з нею, унаслідок чого утворюються дві кислоти: хлоридна й гіпохлоритна. При цьому один атом Хлору підвищує ступінь окиснення, а інший атом – знижує. Такі реакції називають реакціями диспропорціонування. Реакції диспропорціонування – це реакції самовідновлення-самоокиснення, тобто реакції, під час яких один елемент проявляє властивості і окисника, і відновника. При диспропорціонуванні одночасно утворюються сполуки, в яких елемент перебуває в більш окисленому й більш відновленому стані порівняно з первісним. Ступінь окиснення атома Хлору в молекулі гіпохлоритної кислоти дорівнює +1:
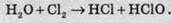
Аналогічно протікає взаємодія хлору з розчинами лугів. При цьому утворюються дві солі: хлорид і гіпохлорит.
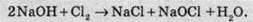
Хлор вступає у взаємодію з різними оксидами:
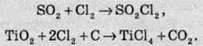
Хлор окислює деякі солі, в яких метал перебуває не в максимальному ступені окиснення:
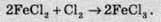
Молекулярний хлор реагує з багатьма органічними сполуками. У присутності ферум(ІІІ) хлориду як каталізатора хлор реагує з бензолом з утворенням хлорбензолу, а при опроміненні світлом у результаті цієї ж таки реакції утворюється гексахлорциклогексан:
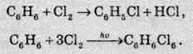
Хімічні властивості брому та йоду
Обидві речовини реагують із воднем, фтором та лугами:
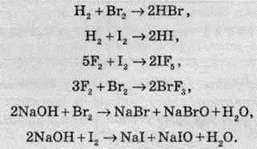
Йод окислюють різні сильні окисники:
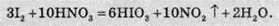
Методи добування простих речовин
Добування фтору
Оскільки фтор є найсильнішим хімічним окисником, то виділити його за допомогою хімічних реакцій зі сполук у вільному вигляді неможливо, а тому фтор добувають фізико-хімічним методом – електролізом.
Для добування фтору використовують розплав калій фториду та нікелеві електроди. Нікель використовують завдяки тому, що поверхня металу пасивується фтором унаслідок утворення нерозчинного NiF2, отже, самі електроди не руйнуються під дією речовини, яка на них виділяється:

Добування хлору
Хлор у промислових масштабах добувають електролізом розчину натрій хлориду. У результаті цього процесу добувають також натрій гідроксид:
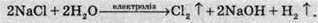
У невеликих кількостях хлор добувають окисненням розчину хлороводню різними методами:
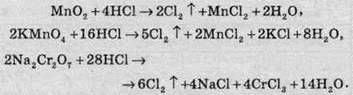
Хлор – дуже важливий продукт хімічної промисловості.
Його світове виробництво складає мільйони тонн.
Добування брому та йоду
Для промислового використання бром і йод добувають при окисненні бромідів та йодидів, відповідно. Для окиснення найчастіше використовують молекулярний хлор, концентровану сульфатну кислоту або манган діоксид:
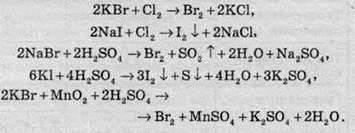
Застосування галогенів
Фтор та деякі його сполуки використовують як окисник ракетного палива. Великі кількості фтору використовують для добування різних холодоагентів (фреонів) та деяких полімерів, яким властива хімічна й термічна стійкість (тефлон та деякі інші). Фтор застосовують в ядерній техніці для поділу ізотопів урану.
Велику частину хлору використовують для добування хлоридної кислоти, а також як окисник для добування інших галогенів. У промисловості його використовують для вибілювання тканин та паперу. У більших кількостях, аніж фтор, його застосовують для виробництва полімерів (ПВХ та інших) і холодоагентів. За допомогою хлору дезінфікують питну воду. Він також потрібен для добування деяких розчинників, таких як хлороформ, хлористий метилен, тетрахлорметан. А ще його використовують для виробництва багатьох речовин, наприклад калій хлорату (бертолетової солі), хлорного вапна та багатьох інших сполук, що містять атоми Хлору.
Бром та йод застосовують у промисловості не в таких масштабах, як хлор чи фтор, однак з кожним роком використання цих речовин збільшується. Бром використовують у виробництві різних медичних препаратів заспокійливої дії. Йод використовують при виготовленні антисептичних препаратів. Сполуки Брому та Йоду широко застосовують при кількісному аналізі речовин. За допомогою йоду очищають деякі метали (цей процес називають йодним рафінуванням), наприклад титан, ванадій та інші.