Різноманіття карбонових кислот. Одержання й використання карбонових кислот
II Семестр
Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Урок 39
Тема уроку. Різноманіття карбонових кислот. Одержання й використання карбонових кислот
Цілі уроку: узагальнити й систематизувати знання учнів про хімічні властивості, одержання й використання карбонових кислот; розширити знання про кислоти на прикладі вищих карбонових кислот, ненасичених кислот, їхніх властивостей, використання, одержання, поширення в природі; ознайомити зі специфічними властивостями мурашиної кислоти; розвивати вміння й навички розв’язування
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна, групова та індивідуальна за картками.
Обладнання: картки-завдання.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Мотивація навчальної діяльності
1. Біля дошки учні пишуть рівняння реакцій відповідно до схеми перетворень:
Натрій ацетат  оцтова кислота
оцтова кислота  хлороцтова кислота
хлороцтова кислота
2. З якими з перелічених речовин
3. Бесіда
¦ Історична назва метанової кислоти – … етанової кислоти – …
¦ З перелічених властивостей до фізичних властивостей оцтової кислоти належать:
А) газ;
Б) рідина;
В) без запаху;
Г) із запахом;
Д) розчинна у воді;
Е) нерозчинна у воді.
¦ Оцтова кислота застосовується:
А) у медицині;
Б) у машинобудуванні;
В) у побуті.
4. Троє учнів біля дошки записують у молекулярній та іонній формах реакції взаємодії між речовинами:
1-й учень:
А) оцтовою кислотою й кальцієм;
Б) пропановою кислотою й калій карбонатом;
2-й учень:
А) пропановою кислотою й кальцій оксидом;
Б) оцтовою кислотою й калій гідроксидом;
3-й учень:
А) пентановою кислотою й магнієм;
Б) метановою кислотою й натрій гідроксидом.
III. Вивчення нового матеріалу
Різноманіття карбонових кислот
1) Запишіть загальну формулу карбонових кислот.
Загальна формула карбонових кислот: R – (COOH)n.
2) Наведіть два-три приклади карбонових кислот:
– насичених;
– ненасичених;
– ароматичних;
– одноосновних;
– двохосновних.
3) Специфічні властивості мурашиної кислоти
Як і всі карбонові кислоти, мурашина кислота утворює естери.
Реакція етерифікації:
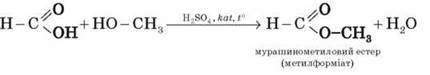
Від решти карбонових кислот мурашина кислота відрізняється тим, що карбоксильна група в ній зв’язана не з вуглеводневим радикалом, а з атомом Гідрогену. Тому мурашину кислоту можна розглядати і як кислоту, і як альдегід:

Подібно до альдегідів, мурашина кислота може окислюватись:
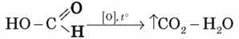
Мурашина кислота дає реакцію “срібного дзеркала”:
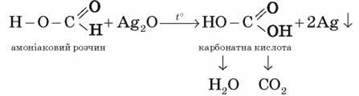
Мурашина кислота розкладається в процесі нагрівання:
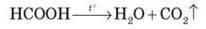
Щавлеву кислоту не можна вважати гомологом мурашиної кислоти, тому що щавлева кислота є двохосновною кислотою:
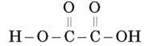
Завдання. Складіть молекулярні та іонні рівняння реакції мурашиної кислоти:
А) з цинком;
Б) з натрій гідроксидом;
В) з натрій карбонатом;
Г) з амоніаковим розчином аргентум оксиду.
За якими ознаками можна судити про перебіг реакції в кожному випадку?
4) Бензойна кислота C6H5COOH – найпростіша ароматична кислота. Складіть структурні формули продуктів її взаємодії з такими речовинами:
А) етанолом (у присутності сульфатної кислоти);
Б) натрій гідрогенкарбонатом;
В) фосфор(V) оксидом (з утворенням ангідриду бензойної кислоти).
5) Висловіть припущення щодо властивостей акрилової кислоти CH2 = CH – COOH. Складіть рівняння можливих реакцій. При цьому врахуйте, що приєднання галогенгідридів до акрилової кислоти суперечить правилу Марковнікова. Спробуйте пояснити чому.
6) З вищих насичених одноосновних карбонових кислот найбільше значення мають пальмітинова C15H31COOH і стеаринова C17H35COOH кислоти. Вони являють собою безбарвні тверді речовини, нерозчинні у воді.
Стеаринова й пальмітинова кислоти можуть бути виділені з рослинних і тваринних жирів. У промисловості ці кислоти одержують шляхом окиснення парафіну, який виділяють з нафти.
Пальмітинова і стеаринова кислоти проявляють властивості, характерні для карбонових кислот. Практичне значення має їх реакція з лугами з утворенням солей. Солі цих кислот – головні компоненти мила. Стеаринову й пальмітинову кислоти застосовують у виробництві мийних засобів, лаків, фарб, лінолеуму, гуми.
Важливим представником ненасичених карбонових кислот є олеїнова кислота C17H33COOH.
CH3 – (CH2)7 – CH = CH – (CH2)7 – COOH
Олеїнова кислота – масляниста рідина, у формі естерів гліцерину входить до складу рослинних жирів. Має властивості карбонових кислот, зумовлені наявністю карбоксильної групи, і властивості алкенів, зумовлені наявністю подвійного зв’язку в карбоновому ланцюзі. У результаті гідрування олеїнова кислота перетворюється на стеаринову.
До вищих ненасичених карбонових кислот належать також лінолева C17H31COOH і ліноленова C17H29COOH кислоти.
Завдання 1. Напишіть рівняння реакції стеаринової та олеїнової кислот з речовинами:
А) натрій гідроксидом;
Б) натрій карбонатом.
Завдання 2. Олеїнова кислота знебарвлює бромну воду. Чому? Складіть рівняння хімічної реакції.
Завдання 3. Запишіть формулу калієвої солі олеїнової кислоти.
Завдання 4. Подумайте, які хімічні реакції допоможуть розрізнити олеїнову і стеаринову кислоти.
7) Застосування:
– виробництво барвників;
– розчинник;
– харчова промисловість;
– виробництво ацетатного волокна;
– виробництво лікарських препаратів та ін.
IV. Підбиття підсумків уроку
Оцінювання роботи учнів на уроці.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Повторити правила безпеки під час роботи в кабінеті хімії. Підготуватися до практичної роботи № 2 “Властивості оцтової кислоти”.