Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції
Тема 2
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
УРОК 37
Тема. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції
Цілі уроку: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними; підготувати учнів до тематичного оцінювання.
Тип уроку: узагальнення й систематизація знань, умінь і навичок.
Форми роботи: виконання
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, картки – завдання.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Самостійна робота за варіантами
Завдання. Заповніть пропуски в таблиці в рядку свого варіанта.
Варіант | Вихідна речовина | Продукт реакції | Рівняння реакції | Вихідна речовина | Продукт реакції | ||
М | M | V | М | M | V |
| |
1 | Са | Са(ОН)2 | 0,5 моль | ||||
2 | CH4 | CO2 | 5 л | ||||
3 | Na2CO3 | NaCl | 10,6 г | ||||
4 | Zn | H2 | 0,1 моль | ||||
5 | AlCl3 | Al(OH)3 | 7,8 г | ||||
6 | MgO | MgCO3 | 8 г | ||||
7 | Fe(OH)3 | Fe2O3 | 0,4 моль | ||||
8 | S | SO2 | 1,8 л | ||||
9 | CO2 | CaCO3 | 2 л |
III. Засвоєння нових умінь і навичок
Практика на прикладах
Завдання 1. Обчисліть кількість речовини води, що виділиться внаслідок термічного розкладання купрум(ІІ) гідроксиду масою 9,8 г.

3) За рівнянням реакції обчислимо кількість речовини води:
 (H2O) = 0,1 моль.
(H2O) = 0,1 моль.
Відповідь: 0,1 моль води.
Під керівництвом учителя учні розв’язують задачі біля дошки.
Завдання 2. Обчисліть маси вихідних речовин, необхідних для одержання 98 кг сульфатної кислоти.

3) За рівнянням реакції обчислимо кількість речовини SO3 й Н2O:
 (SO3) = 1000 моль;
(SO3) = 1000 моль;
 (H2O) = 1000 моль.
(H2O) = 1000 моль.
4) Обчислимо маси вихідних речовин за формулою  = m/M:
= m/M:
M(SO3) = 80 г/моль – 1000 моль = 80 000 г = 80 кг;
M(Н2O) = 18 г/моль – 1000 моль = 18 000 г = 18 кг.
Відповідь: 18 кг Н2O, 80 кг SO3.
Завдання 3. У результаті взаємодії деякого двовалентного металу масою 11,2 г з розчином хлоридної кислоти виділився водень об’ємом 4,48 л. (н. у) Визначте цей метал.
Розв’язання
1) Для розв’язання задачі складемо рівняння реакції в загальному вигляді:
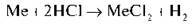
2) Обчислимо кількість речовини водню за формулою  = V/Vm:
= V/Vm:
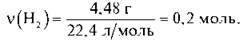
3) За рівнянням реакції обчислимо кількість речовини металу:
 (Me) =
(Me) =  (H2) = 0,2 моль.
(H2) = 0,2 моль.
4) Обчислимо молярну масу металу:
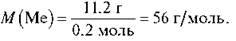
5) 3 допомогою періодичної системи знайдемо метал з атомною масою 56 г/моль. Це Ферум.
Відповідь: залізо.
IV. Закріплення нового матеріалу
Незалежна практика
Учні самостійно розв’язують задачі з наступним обговоренням результату.
Завдання 4. Тривалентний метал масою 32,4 г розчинили в сульфатній кислоті. При цьому виділився водень об’ємом 40,32 л (н. у.). Визначте цей метал.
Завдання 5. Для відновлення двовалентного металу з оксиду масою 11,15 г витратили водень об’ємом 1,12 л (н. у.). Визначте цей метал.
Завдання 6*. У розчин аргентум(І) нітрату занурили металеву пластинку. При цьому виділилося 3,4 г срібла, а маса пластинки зменшилася на 6,5 г. Визначте метал, якщо відомо, що він розташований у II групі періодичної системи хімічних елементів.
V. Підбиття підсумків уроку
Учитель підбиває підсумки роботи учнів на уроці, оцінює роботу груп.
VI. Домашнє завдання
Повторити фізичні й хімічні властивості класів неорганічних сполук, способи їх одержання.