Розвиток понять “кислоти” й “основи” – Визначення кислот і основ
КИСЛОТИ Й ОСНОВИ
1. Визначення кислот і основ
Кислотами зазвичай вважають речовини, водні розчини яких мають такі властивості:
– кислий смак;
– розчиняють неблагородні метали, виділяючи водень;
– розкладають карбонати (наприклад, вапняк) з виділенням карбон діоксиду;
– змінюють забарвлення індикаторів.
До основ відносяться речовини, водні розчини яких (луги) мають такі властивості:
– мильні на дотик;
– змінюють забарвлення індикаторів;
– нейтралізують кислоти.
Виходячи з перерахованих
1.1. Розвиток понять “кислоти” й “основи”
Деякі оксиди неметалів реагують з водою, утворюючи речовини, водні розчини яких кислі. Звідси в 1775 р. було дано перше визначення кислот.
Оксигеновмісні кислоти утворюються в результаті реакції оксидів неметалів з водою (Антуан Лавуазьє).
Приклад. Сульфур діоксид і фосфор(V) оксид реагують з водою, утворюючи сульфітну і фосфатну кислоти:
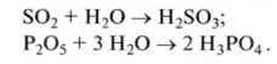
З іншого боку, деякі оксиди металів, вступаючи в реакцію з водою, утворюють гідроксиди, водні розчини яких мають лужні властивості.
Приклад.
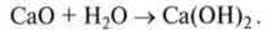
Більш загальне визначення кислот, подане в 1838 р., розглядає як оксигеновмісні, так і безоксигенові кислоти.
Кислоти – це речовини, що містять Гідроген, який може заміщуватися металом (Юстут фон Лібіх).
Приклад. Хлоридна кислота розчиняє магній з виділенням водню:

Наступне визначення кислоти, подане в 1887 р., виходить з того факту, що водні розчини кислот і лугів містять іони Гідрогену або гідроксид-іони.
Кислоти – речовини, які при розчиненні у воді відщеплюють іони Гідрогену (протони). Основи – речовини, які при розчиненні у воді відщеплюють гідроксид-іони (Сванте Ареніус).
Приклад. Газоподібний гідроген хлорид при розчиненні у воді відщеплює протони, а твердий натрій гідроксид при розчиненні у воді відщеплює гідроксид-іони.
Запам’ятайте: розпад речовин на іони називають дисоціацією.
Related posts:
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- КИСЛОТИ І ОСНОВИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ І ОСНОВИ Загальним для всіх кислот при їх взаємодії з водою є утворення іона оксонію Н3O+ (саме цей іон, зокрема, викликає зміну забарвлення індикаторів), тому більш точне визначення класу речовин-кислот порівняно з тим, яке було подано раніше, таке: Кислотою називається речовина, яка при взаємодії з водою (при розчиненні у […]...
- Кислоти й основи, за Льюїсом – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.3. Кислоти й основи, за Льюїсом Визначення, запропоноване Гілбертом Н. Льюїсом, не обмежується розглядом перенесення протонів. Згідно з цим визначенням, кислотами є частинки, атоми яких мають незаповнені валентні оболонки. Кислота – це частинка з незавершеною електронною конфігурацією. Основа є частинкою, яка надає пару електронів для утворення ковалентного […]...
- Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Слабкі кислоти й основи У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули. Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги: Оскільки в цьому випадку концентрація молекул води […]...
- Теорія Бренстеда – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.2. Теорія Бренстеда Багато речовин утворюють кислі або лужні розчини, але не відповідають наведеним визначенням кислот і лугів. Приклад. Розчин амоній хлориду має кислу реакцію, а розчин натрій ацетату – лужну. У зв’язку з цим Йоганн Бренстед і Томас Лоурі сформулювали в 1923 р. нове визначення кислот […]...
- Водневий показник розчинів слабких кислот і основ – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Водневий показник розчинів слабких кислот і основ Оскільки при протолізі кислоти чи основи утворюється рівна кількість позитивних і негативних іонів, їхня концентрація буде однаковою: Якщо в даних рівняннях прологарифмувати значення концентрацій іонів (Н3О+) і (ОН-), то одержимо значення pH розчину кислоти або значення рОН […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Нейтралізація слабких кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація При змішуванні рівних об’ємів соляної кислоти і розчину їдкого натру однакових концентрацій, утворюється нейтральний розчин натрій хлориду, що має показник pH = 7. Таким чином, кислотні і лужні властивості початкових речовин нейтралізуються. Нейтралізація є реакцією взаємодії іонів гідроксонію і гідроксид-іонів з утворенням молекул води: Н3О+ + ОН – 2 Н2О. […]...
- Протолітична теорія кислот і основ – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.13. Протолітична теорія кислот і основ Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації NaOH + НСl = NaCl + Н2O; КОН + […]...
- Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.7. Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації Згідно з теорією електролітичної дисоціації, кислоти – це сполуки, які дисоціюють на катіони Гідрогену1 та аніони кислотного залишку: Як уже згадувалось, багатоосновні кислоти дисоціюють ступінчасто. Основність кислоти визначається […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА ЛАБОРАТОРНИЙ ДОСЛІД 6 Випробування водних розчинів кислот і лугів індикаторами Речовини та обладнання: пробірки, штатив для пробірок, вода, натрій гідроксид, станова кислота, індикатори. Завдання 1. Користуючись індикаторами, перевіримо, як змінюються їх кольори у воді, водних розчинах кислоти і лугу. Для цього налили в першу пробірку 1 мл води, у другу […]...
- Вибір індикатора – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Вибір індикатора Для визначення точки еквівалентності при титруванні потрібно мати відповідний індикатор, зміна кольору якого відбувається в межах області значень pH, в якій крива титрування проходить вертикально. Запам’ятайте: – Крива титрування сильних лугів сильними кислотами має велику (область значень pH по вертикалі. Для визначення точки […]...
- Проведення титрування – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Проведення титрування Для визначення концентрації кислоти або лугу потрібне таке приладдя: – піпетка для відмірювання певного об’єму кислоти або основи невідомої концентрації; – бюретка для вимірювання розчину відомої концентрації; – Колба Ерленмейера (зі зразком) для розміщення відміряного об’єму розчину, що визначається, невідомої концентрації. Після додавання […]...
- Електролітична дисоціація кислот, основ, солей у водних розчинах Тема 1 РОЗЧИНИ Урок 12 Тема уроку. Електролітична дисоціація кислот, основ, солей у водних розчинах Цілі уроку: поглибити знання учнів про електролітичну дисоціацію на прикладі розчинів кислот, основ і солей; формувати навички складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей; уточнити визначення кислот, основ і солей у світлі теорії електролітичної дисоціації. Тип уроку: засвоєння […]...
- Електроліз водних розчинів електролітів (кислот, основ, солей) – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз 6.13.2. Електроліз водних розчинів електролітів (кислот, основ, солей) Під час електролізу водних розчинів електролітів, крім катіонів і аніонів розчиненої речовини, у процесах окиснення і відновлення, що відбуваються на електродах, можуть брати участь молекули води. При цьому можуть […]...
- Індикатори – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Титрування – це кількісний спосіб визначення невідомої концентрації розчину. При титруванні методом нейтралізації шукана концентрація кислоти визначається за допомогою лугу відомої концентрації. Індикатори Для визначення точки еквівалентності необхідний кислотно-основний індикатор. Такий індикатор є найчастіше слабкою кислотою, яка має інше забарвлення, відмінне від відповідної зв’язаної основи. […]...
- Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи Тема 3 Вода & 24. Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи Опанувавши цю тему, ви зможете: – розрізняти основи й кислоти як гідрати оксидів; – наводити приклади гідратів оксидів, утворених оксидами неметалічних і металічних елементів; – розпізнавати кислоти й основи, розчинні у воді, за допомогою індикаторів; – складати рівняння реакцій […]...
- Агрегатний стан, розчинність – Властивості карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти 5.3. Властивості карбонових кислот Перші представники карбонових кислот (С1-С3) мають різкий специфічний запах, зі збільшенням вуглеводневого радикала (С4-С9) неприємний запах зникає. Агрегатний стан, розчинність Фізичні властивості пов’язані з полярністю карбоксильної групи. Полярність обумовлює утворення водневих зв’язків з молекулами води або іншими молекулами карбонових кислот. – Нижчі члени гомологічного […]...
- Основи, їх склад і назви. Класифікація основ Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 15 Тема. Основи, їх склад і назви. Класифікація основ Цілі уроку: розширити знання про класифікацію й номенклатуру неорганічних речовин на прикладі основ; розвивати вміння й навички складати формули неорганічних сполук за валентністю на прикладі основ, складати назви речовин за сучасною українською номенклатурою, розпізнавати класи неорганічних речовин. Тип уроку: […]...
- Основи – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.3. Основи Визначення класу основ див. § 5.8. Наведені там приклади дисоціації основ точніше, із урахуванням гідратації іонів, слід писати так: КОН (к.) ⇆ К+ (водн.) + ОН – (водн.); NH3 ∙ Н2О1 ⇆NH+4 (водн.) […]...
- Розв’язування типових задач Оксиди, кислоти, основи, солі – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.7. Розв’язування типових задач Оксиди, кислоти, основи, солі Задача 1. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення; CuSO4 -> Сu -> СuО -> СuСl2 -> Сu(OН)2 -> Cu(OH)NO3 -> Сu(NO3)2. Розв’язання. 1) […]...
- Таблиця розчинності кислот, основ та солей у воді ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 3 Таблиця розчинності кислот, основ та солей у воді...
- Загальні способи одержання оксидів, основ, кислот, солей Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 34 Тема. Загальні способи одержання оксидів, основ, кислот, солей Цілі уроку: розвивати вміння й навички учнів у складанні рівнянь на прикладі одержання оксидів, основ, кислот, солей; систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей; показати їх взаємозв’язок з генетичним зв’язком класів неорганічних сполук. Тип […]...
- Кислоти – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.2. Кислоти Означення класу кислот з погляду теорії електролітичної дисоціації див. § 5.8. Наведені там приклади рівнянь їх дисоціації можна записати точніше, із урахуванням гідратації іонів: НСl (газ) ⇆Н+ (водн.) + Сl (водн.); СН3СООН (водн.) […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Тема 3 ВОДА & 36. ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Вивчення параграфа допоможе вам: · наводити приклади формул кислот і основ; · складати рівняння реакцій води з деякими оксидами; · розпізнавати дослідним шляхом кислоти і луги Вода вступає в хімічні реакції з багатьма речовинами. Розглянемо, як вона взаємодіє з оксидами та […]...
- Значення pH буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Суміш слабкої кислоти і зв’язаної основи, або слабкої основи і її зв’язаної кислоти характеризується тим, що її водневий показник при додаванні не дуже великої кількості іонів гідроксонію або гідроксид-іонів практично не змінюється. Розчини, показник pH яких по відношенню до кислот і лугів залишається стабільним, називають буферними […]...
- Основи – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Основи Поняття про основи, їхній склад та назви Неорганічні основи ще називають гідроксидами, тому що вони складаються з двох частин: атомів металічних елементів та гідроксигруп Е(ОН)х. Наприклад, NaOH, Са(ОН)2, Аl(OН)3. Основи – це складні речовини, які складаються з атома […]...
- Аміди кислот – АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 18. АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 18.5. Аміди кислот Амідами карбонових кислот називаються похідні цих кислот, у яких гідроксильна група заміщена аміногрупою. Наприклад: Загальна формула амідів RCONH2. Функціональна група – Називається амідогрупою. Назви амідів утворюють від назв кислот, з яких вони утворились, […]...
- Кислоти – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Кислоти Поняття про кислоти, їхній склад та назви Кислоти – це складні речовини, які складаються з атомів Гідрогену, що можуть заміщатися атомами металічних елементів, та кислотних залишків. Згідно із теорією кислот та основ Арреніуса, кислотам можна дати інше визначення, […]...
- Дія буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Дія буферів Використовуючи константу рівноваги процесу дисоціації кислоти, можна показати дію буфера: – Додавання кислоти, тобто збільшення с(Н3О+). Для збереження рівноваги додані іони гідроксонію реагуватимуть з відповідними іонами А-, утворюючи недисоційовану НА, практично не змінюючи концентрацію іонів гідроксонію. – Додавання лугу, тобто збільшення с(ОН-). Додані гідроксид-іони […]...