Сильні та слабкі електроліти – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ
Сильні та слабкі електроліти
Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі – частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, а також Барію, Стронцію й Кальцію) та деякі кислоти (НСl, НВr, НІ, HNO3, H2SO4(розб)). Інші електроліти відносять до слабких.
Силу
У кислот, до складу яких атоми Оксигену не входять
Силу оксигеновмісних кислот можна визначити за формулою Е(ОН)mОn. Якщо n < 2 – кислота слабка, якщо n більше або дорівнює 2 – сильна.
Взаємозв’язок сили кислоти із числом атомів Оксигену, які не входять до складу гідроксильних груп, можна пояснити в такий, спосіб. Атом Оксигену, як найбільш електронегативний, притягує до себе спільні електронні пари. У результаті електронна густина від атома Оксигену в групі ОН зміщується в бік кислото-твірного елемента й зв’язок між атомами Оксигену та Гідрогену в гідроксильній групі стає більш полярним.
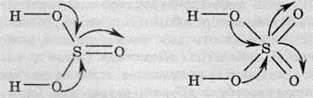
Чим більше число атомів Оксигену, які не входять до групи ОН, тим полярніший зв’язок і сильніша кислота.
Залежність сили кислот від складу кислотного залишку
Кислота | Формула | N | Характер електроліту | |
HmEOn+m | E(OH)mOn | |||
Сульфатна | H2SO4 | S(OH)2O2 | 2 | Сильний |
Сульфітна | H2SO3 | S(OH)2O | 1 | Слабкий |
Нітратна | HNO3 | N(OH)O2 | 2 | Сильний |
Нітритна | HNO2 | N(OH)O | 1 | Слабкий |
Карбонатне | H2CO3 | C(OH)2O | 1 | Слабкий |
Ортофосфатна | H3PO4 | P(OH)3O | 1 | Слабкий |
Гіпохлоритна | HClO | Cl(OH) | 0 | Слабкий |
Хлоритна | HClO2 | Cl(OH)O | 1 | Слабкий |
Хлоратна | HClO3 | Cl(OH)O2 | 2 | Сильний |
Перхлоратна | HClO4 | Cl(OH)O3 | 3 | Сильний |
Ступінь дисоціації
Для кількісного опису сили електролітів використовують поняття “ступінь дисоціації”.
Ступенем дисоціації а називають відношення числа молекул, що розпалися на іони (продисоційованих), до загального числа розчинених молекул.
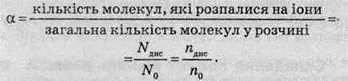
Різні електроліти дисоціюють на іони різною мірою. Як випливає з наведеного рівняння, ступінь дисоціації може змінюватися від 0 до 1. Ступінь дисоціації часто виражають у відсотках. Слід зазначити, що при дисоціації відбувається збільшення числа частинок у розчині. Наприклад, якщо в розчині перебуває електроліт типу Kat+An”, який повністю розпадається на іони, то число частинок збільшується у два рази.
Ступінь дисоціації також є характеристикою, за якою можна визначити, є електроліт сильним чи слабким. Так, якщо ступінь дисоціації електроліту в 0,1 М розчині більший 30 %, то його відносять до сильних електролітів, а якщо менший 3% – до слабких. Електроліти, в яких ступінь дисоціації має проміжні значення, відносять до електролітів середньої сили.
Ступені дисоціації слабкого електроліту, визначені різними способами (наприклад, за виміром електропровідності або температурою кипіння розчину), найчастіше збігаються. Однак для сильних електролітів визначення ступеня дисоціації різними способами дає різні результати. Отже, величина ступеня дисоціації не характеризує реальну (справжню) ступінь дисоціації, а представляє уявну величину.
Цей, а також низка інших фактів призвели до перегляду теорії Арреніуса у 20-х роках минулого сторіччя й до уточнення, внаслідок чого з’явилася нова теорія електролітів, яка враховує електростатичну взаємодію між іонами. Найбільший внесок у розвиток нової теорії зробив голландський учений П. Дебай.
Згідно із цією теорією, передбачається, що сильні електроліти в розведених розчинах дисоціюються повністю (α = 1). Відмінність виміряного ступеня дисоціації сильних електролітів від одиниці пояснюється електростатичними взаємодіями між різнойменно зарядженими іонами, тобто, якщо для якого-небудь сильного електроліту виміряний ступінь дисоціації α = 70%, то, згідно із новою теорією електролітів, це означає, що всі молекули дисоційовані на іони, але іони вільні лише на 70%, решта 30% іонів “зв’язані” електростатичними взаємодіями.