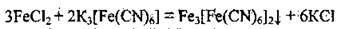Сполуки Феруму (II) – Ферум
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.5. Ферум
Ферум розміщується у побічній підгрупі VIII групи1 четвертого періоду періодичної системи, належить до d-елементів. Хімічний символ – Fe. Порядковий номер – 26, заряд ядра – +26. Відносна атомна маса – 56. Утворює просту речовину залізо. Природний Ферум складається із чотирьох стабільних ізотопів: 54Fe (5,85 %), 56Fe (91,75 %), 57Fe (2,12 %) і 58Fe (0,28 %). Відомо також більш ніж 20 нестабільних ізотопів
Електронна формула – 26Fe 3d64s2. Валентні електрони в атомі Феруму розміщуються у зовнішньому електронному шарі (4s2) та передостанньому (3d6). Атом легко втрачає 4s2-електрони, утворюючи йони Fe2+: 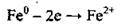
У збудженому стані один електрон з 3d-підрівня може переходити на 4p-підрівень (така електронна конфігурація також доволі стабільна) і ставати валентним:
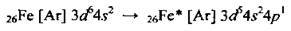
Таким чином найхарактерніші валентності Феруму – II і III, ступені окиснення – +2, +3 (інколи +6).
Ступені окиснення | +2 | +3 | +6 |
Приклади | FeO, FeCl2, Fe(OH)2 | Fe2O3, FeCl3 Fe(OH)3 | K2FeO4 |
Електронегативність за Полінгом – 1,83.
Поширення Феруму уприроді
Ферум – 4-й за поширеністю елемент (і 2-й серед металічних елементів) земної кори (за масою). Утворює значну кількість мінералів, переважно силікатів. Найбільше значення мають: магнітний залізняк (магнетит) Fe3O42, червоний залізняк (гематит) Fe2O3, бурий залізняк (лимоніт) 2Fe2O3 · 3Н2O, сидерит (залізний шпат) FeCO3, залізний, або сірчаний, колчедан (пірит)FeS2.
За сучасними уявленнями ядро нашої планети має середній радіус 3,5 тис. км3, масу 1,932 · 1024 кг і на 79-85 % складається із Феруму (у вигляді сплаву з Силіцієм (6-7 %), Ніколом (4,9-5,2 %) та іншими елементами).
У морській воді його мало – 0,002-0,02 мг/л. У прісній воді, залежно від джерела, концентрація Феруму може значно коливатися – від 0 до 2 мг/л і більше, що не тільки впливає на органолептичні властивості води, а й робить її токсичною і непридатною для пиття4.
Трапляється самородне залізо (Гренландія) і чавун (Далекий Схід).
До поверхні нашої планети5 долітає 5-6 т метеоритів на добу (космічного пилу – від 300 до 20 000 т). Вони бувають залізними (приблизно один із шістнадцяти), залізо-кам’яними та кам’яними. Залізні метеорити складаються з 91 % Феруму, приблизно 8,5 % Ніколу та інших елементів. Інші також містять у своєму складі Ферум (від 1 до 50 %). За сучасними уявленнями вони є похідними астероїдів.
Ферум (у вигляді йона Fe2+) є складовою частиною гему – комплексної сполуки порфірину, що входить до складу гемоглобіну, міоглобіну, пероксидази, цитохромів тощо.
Фізичні властивості заліза
Чисте залізо – сріблясто-білий метал, має високу пластичність, легко кується. Температура плавлення – 1539 °С, температура кипіння – 2861 °С. Має феромагнітні властивості (притягується магнітом), добре проводить теплоту та електричний струм, хоча й поступається таким металам, як золото, срібло, мідь, алюміній.
Хімічні властивості заліза
Ферум розміщується в середині електрохімічного ряду напруг, а тому є металічним елементом середньої хімічної активності. Під час хімічних реакцій виявляє відновні властивості. Залізо реагує:
1) з простими речовинами:
– під час нагрівання залізо окислюється більшістю неметалів:
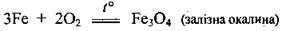
Окалина утворюється при окисненні заліза в атмосфері чистого кисню, а на повітрі – ферум(ІІІ) оксид Fe2О3.
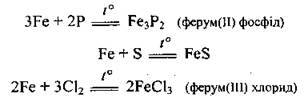
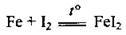 (утворення солі Fe2+ характерно лише для йоду як слабкого окисника)
(утворення солі Fe2+ характерно лише для йоду як слабкого окисника)
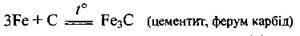
2) зі складними речовинами:
– взаємодія з водою (корозія) за стандартних умов відбувається лише, якщо є кисень:
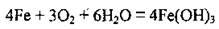
– розпечене залізо реагує з водяною парою:
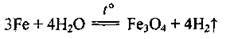
– з кислотами:
А) з кислотами, що є слабкими окисниками (за відсутності кисню):
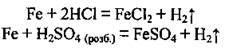
Б) з нітратною кислотою:
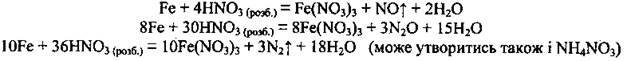
В) при нагріванні з концентрованими нітратною та сульфатною кислотами (на холоді вони пасивують залізо):
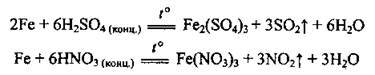
– з розчинами солей менш активних металів:
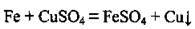
Зауважимо, що утворюються солі двовалентного Феруму.
Добування заліза
Хімічно чисте залізо отримують електролізом розчинів його солей. Також залізо добувають відновленням природних оксидів воднем (з подальшим переплавлянням в електричних печах):
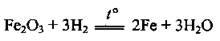
___________________________________________________________
1 За новою номенклатурою – у VIII групі.
2 Формула Fe3О4, яку для зручності написання традиційно використовують, є некоректною. Правильна формула цієї речовини – 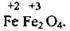
3 Середній радіус Землі становить 6,37 тис. км.
4 Гранично допустима концентрація (ГДК) Феруму у воді – 0,3 мг/л.
5 Цікаво, що метеорити нерівномірно вкривають площу поверхні Землі. Існують ділянки (наприклад, зона Мовчання в Мексиці, що розташована за 6 км від техаського містечка Ель-Пасо), які ніби притягують метеорити, зокрема завдяки аномальним показникам магнітного поля.
8.5.1. Сполуки Феруму (II)
Сполуки Феруму (II) виявляють відновні властивості, оскільки йон Fe2+ легко окислюється до Fe3+. Ферум(ІІ) оксид FeO – тверда кристалічна речовина чорного кольору з атомними кристалічними гратками. У воді не розчиняється. Це основний оксид, якому також притаманні відновні властивості. Реагує з кислотами, кислотними оксидами:
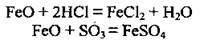
При взаємодії з киснем та нітратною кислотою ферум(ІІ) оксид виявляє відновні властивості:

Добування ферум(ІІ) оксиду
Термічний розклад ферум(ІІ) карбонату в атмосфері азоту:
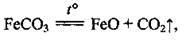
А також іншими реакціями:
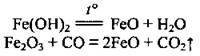
Термоліз ферум(ІІ) оксалату (солі щавлевої кислоти):
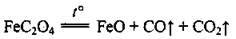
Ферум(ІІ) гідроксид Fe(OH)2 – порошок білого кольору, не розчиняється у воді.
Має основний характер і виявляє відновні властивості:
– реагує з кислотами:
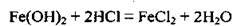
– окислюється окисниками:
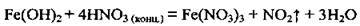
На повітрі окислюється до Fe(OH)3 бурого кольору:
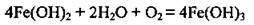
– при нагріванні розкладається:
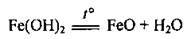
Добування ферум(ІІ) гідроксиду
Його одержують при взаємодії лугів з розчинними у воді солями Феруму (II):
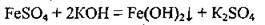
Свіжоосаджений ферум(ІІ) гідроксид має зеленкуватий колір, на повітрі швидко змінює своє забарвлення – буріє 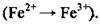
Солі Феруму (II)
Сполуки Fe (II) нестійкі, окислюються на повітрі:
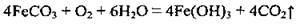
Окислюються іншими окисниками:
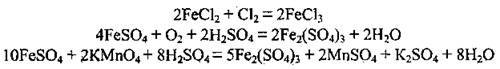
Ферум(ІІ) сульфат при нагріванні розкладається:
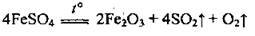
Якісна реакція на йон Fe2+: реактив – калій гексаціаноферат(ІІІ) (червона кров’яна сіль). Утворюється осад турнбулевої сині: