Сполуки Магнію і Кальцію
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП
§ 63. Сполуки Магнію і Кальцію
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати властивості оксидів, основ та солей Магнію і Кальцію;
Складати рівняння відповідних хімічних реакцій; обгрунтовувати застосування сполук їх властивостями; визначати йони Кальцію за забарвленням полум’я.
Магній і Кальцій – металічні елементи, тому до їх головних сполук належать основні оксиди, гідроксиди та солі.
Оксиди. Кальцій оксид називається
Фізичні властивості. Це білі тверді кристалічні речовини (мал. 112). Завдяки більшій міцності їх кристалічних граток порівняно з оксидами лужних елементів вони мають вищі температури плавлення і більшу густину.
Добування оксидів Магнію і Кальцію в лабораторії та промисловості

Мал. 112. Оксиди: а – Кальцію; б – Магнію
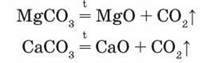
Хімічні властивості оксидів Магнію та Кальцію зумовлені їх приналежністю до класу основних оксидів: вони взаємодіють з кислотами, кислотними й амфотерними оксидами та амфотерними гідроксидами.
– Складіть рівняння відповідних реакцій.
Магній оксид у реакції з водою малоактивний. Під час реакції кальцій оксиду з водою виділяється велика кількість теплоти. Ця реакція називається гашенням вапна, а добутий кальцій гідроксид – гашеним вапном:
СаО + Н2О = Са(ОН)2
ЛАБОРАТОРНИЙ ДОСЛІД
ВЗАЄМОДІЯ КАЛЬЦІЙ ОКСИДУ З ВОДОЮ
Помістить у порцелянову чашку підготовлені заздалегідь прожарюванням крейди грудочки негашеного вапна. За допомоги піпетки додайте кілька крапель води. Спостерігайте бурхливий перебіг реакції, що супроводжується шипінням і сильним розігріванням суміші. Грудочки розсипаються на порошок кальцій гідроксиду. Відбувся процес гашення вапна.
Застосування. Оксиди Магнію і Кальцію застосовують у виробництві будівельних матеріалів. Завдяки добавкам магнезії МgО до цементу підвищується його в’яжуча здатність. При твердненні такого цементу утворюється монолітна маса. З неї виготовляють збірні залізобетонні та бетонні конструкції – перекриття, сходи, різноманітні архітектурно-декоративні деталі (мал. 113).
Гідроксиди Магнію Мg(ОН)2 та Кальцію Са(ОН)2 є типовими основами, з них кальцій гідроксид належить до лугів. Це білі, тверді, кристалічні речовини (мал. 114, а, б). Магній гідроксид – нерозчинний у холодній воді, кальцій гідроксид – малорозчинний. Прозорий розчин кальцій гідроксиду називають вапняною водою, а водну суспензію сполуки – вапняним молоком (мал. 114, в).
Для магній і кальцій гідроксидів характерні типові реакції класу основ: вони взаємодіють з кислотними й амфотерними оксидами, амфотерними гідроксидами, кислотами, солями.
-Напишіть рівняння відповідних реакцій у молекулярній та йонних формах.

Мал. 113. Воронцовський палац в Одесі (а), колона “Геракли” (б)

Мал. 114. Кальцій гідроксид (а), магній гідроксид (б), вапняне молоко (в)
При пропусканні карбон(IV) оксиду крізь вапняну воду утворюються карбонати і гідрогенкарбонати, які легко взаємоперетворюються:
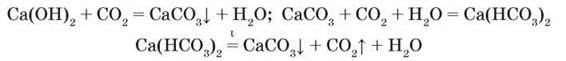
На відміну від гідроксидів Натрію і Калію гідроксиди Магнію та Кальцію розкладаються при нагріванні:
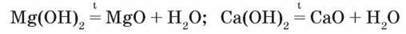
Застосування. Гашене вапно широко використовується в будівництві. Вапняне молоко застосовують у цукровій промисловості для очищення бурякового соку від домішок, виготовлення сумішей для боротьби з хворобами рослин, побілення стовбурів дерев. Як і гашене вапно магній гідроксид використовують для очищення цукру, він входить до складу зубних паст.
Солі Магнію та Кальцію. Найбільше практичне значення мають карбонати, сульфати, фосфати. Ви вже дізналися про фізичні, хімічні властивості, способи добування зазначених солей під час вивчення відповідних кислот. Розглянемо найважливіші з них.
Кальцій карбонат СаСО3 – одна з найпоширеніших сполук на Землі. Вам добре відомі такі його мінерали, як крейда, мармур, вапняк, загальна назва яких – кальцити. Найважливіший з них – вапняк. По-перше, він є чудовим будівельним матеріалом. Пригадайте одеські катакомби, в минулому каменоломні, в яких добували цей матеріал для будівництва міста (мал. 115, а). По-друге, це – сировина для виготовлення інших будівельних матеріалів: цементу, гашеного і негашеного вапна, скла та ін. Вапняним щебенем укріплюють полотно дороги, а його порошком – зменшують кислотність грунтів (вапнування грунтів).
– Поясніть, на якій властивості кальцій карбонату засновано вапнування грунтів.

Мал. 115. Одеські катакомби (а), Тадж-Махал (б)
Природна крейда утворилася з решток черепашок давніх тварин. З прикладами її застосування ви зустрічаєтеся щодня, наприклад шкільна крейда, зубні пасти. Крейда застосовується у виробництві паперу, гуми, для побілки приміщень.
Мармур – це матеріал скульпторів. У світі чимало творінь великих митців з мармуру, наприклад споруджений в Індії мавзолей Тадж – Махал (мал. 115, б).
Магній карбонат MgCO3 застосовують у виробництві скла, цементу, цегли.
Кальцій сульфат СаSO4 трапляється у природі у вигляді мінералу гіпсу СаSO4 – 2Н2О. Використовується в будівництві, медицині (гіпсові пов’язки), для виготовлення зліпків. Для цього застосовують напівводний гіпс 2СаSO4 – Н2О – алебастр, якій при взаємодії з водою утворює гіпс:
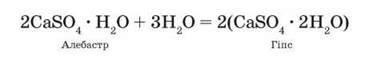
Магній сульфат MgSO4 відомий під назвою гірка, або англійська, сіль. Застосовується в медицині як проносний засіб. Міститься в морській воді, надаючи їй гіркого смаку.
Кальцій фосфат Са3(РО4)2 входить до складу гірської породи фосфориту і мінералу апатиту, є в кістках та зубах тварин і людини. Використовується як добриво.
Для визначення Кальцію використовують його властивість забарвлювати полум’я в оранжево-червоний колір (мал. 116). Сполуки Магнію полум’я не забарвлюють.

Мал. 116. Забарвлення полум’я йонами Са2+
Коротко про головне
Головними сполуками Магнію та Кальцію є основні оксиди та гідроксиди, солі. Магній оксид MgO називається білою магнезією, кальцій оксид СаО – негашеним вапном. Як основні оксиди вони реагують з кислотними оксидами, кислотами, амфотерними оксидами і гідроксидами.
З водою частково реагує лише кальцій оксид. При цьому утворюється луг кальцій гідроксид, який називається гашеним вапном. Магній оксид за стандартних умов у воді не розчиняється. Прозорий розчин Са(ОН)2 називають вапняною водою, водну суспензію сполуки – вапняним молоком. При нагріванні цей гідроксид розкладається на оксид і воду.
Більшість солей Кальцію та Магнію (карбонати, сульфати, фосфати) поширені у природі й використовуються повсюдно.
Для допитливих. Історія відкриття цілющих властивостей коралової води пов’язана з вивченням довголіття населення японських островів Окінава і Токуносіма. Вчені-геронтологи помітили, що тривалість життя на цих островах на 10 – 15 років вище, їх мешканці різняться відмінним здоров’ям, ніж загалом у Японії. Пізніше було встановлено причину: виявляється, ці острови є кораловими атолами; внаслідок фільтрації коралами вода оточуючих морів насичується йонами Кальцію, які є цілющими для людини.