Сполуки неметалічних елементів з Гідрогеном. Гідроген хлорид. Хлоридна кислота
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 8
Тема уроку. Сполуки неметалічних елементів з Гідрогеном. Гідроген хлорид. Хлоридна кислота
Цілі уроку: розширити знання про хімічні властивості неметалів на прикладі їхніх сполук із Гідрогеном, знання про властивості кислот на прикладі гідроген хлориду та хлоридної кислоти, властивості хлоридів; продовжити формування практичних умінь і навичок визначення речовин на прикладі якісної реакції на хлорид-іон; повторити правила безпечного використання кислот;
Тип уроку: засвоєння знань, умінь і навичок.
Форми роботи: фронтальна бесіда з теми, лабораторна робота, самостійна робота.
Обладнання: періодична таблиця хімічних елементів, таблиця розчинності.
Демонстрація 5. Хімічні властивості хлоридної кислоти.
Лабораторний дослід 3. Якісна реакція на хлорид-іон.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
1. Відповіді на
1) За яких умов взаємодіють із киснем сірка, азот, вуглець? Запишіть рівняння реакцій горіння вуглецю в нестачі й надлишку кисню.
2) Порівняйте умови взаємодії сірки, азоту, вуглецю з воднем. Які властивості проявляє водний розчин сполуки Сульфуру з Гідрогеном, Сульфуру з Нітрогеном, Сульфуру з Карбоном?
3) Запишіть рівняння реакцій взаємодії сірки, азоту, вуглецю з магнієм. Назвіть одержані речовини. До якого класу належать ці речовини?
2. Групові завдання
1) Запишіть схему будови атома Хлору. Визначте можливі ступені окиснення. Поясніть відповідь.
2) Атом Хлору утворює стійкі сполуки з різними ступенями окиснення. Зобразіть схему утворення молекули хлору. Укажіть тип зв’язку.
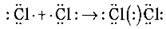
3) Напишіть рівняння реакції взаємодії водню та хлору, укажіть тип реакції й умови її перебігу.
Горіння водню в хлорі:
H2 + Cl2  2HCl
2HCl
Ця реакція може протікати інакше. Якщо змішати хлор з воднем у товстостінному циліндрі, прикрити отвір і поблизу запалити магній, то в циліндрі станеться вибух. Яскраве світло спричинить вибух суміші. Реакція починається з розщеплення молекули хлору:
Cl2  2Cl-
2Cl-
Атом Хлору, стикаючись із молекулою водню, зв’язує один атом Гідрогену в молекулу гідроген хлориду, вивільняючи другий атом:
Н2 + Cl  HCl + H-
HCl + H-
Атом Гідрогену реагує з іншою молекулою хлору:
H – + Cl2  HCl + Cl-
HCl + Cl-
І так далі. Такі реакції називаються ланцюговими.
Хімічна активність Хлору як окисника проявляється й під час узаємодії з водою. Якщо виставити на світло колбу з хлорною водою, то відбувається реакція:
H2O + Cl2  HCl + HClO
HCl + HClO
HClO  HCl + O*
HCl + O*
2O*  O2
O2
Сумарно:
2H2O + 2Cl2  4HCl + O2
4HCl + O2
На цій реакції грунтується застосування хлору.
ІІІ. Вивчення нового матеріалу
Гідроген хлорид. хлоридна кислота
1. Гідроген хлорид
Гідроген хлорид HCl – безбарвний задушливий газ, добре розчинний у воді (в 1 л води розчиняється до 500 л гідроген хлориду за кімнатної температури). Розчин відомий як хлоридна, або соляна, кислота, максимальна концентрація – до 40 %.
У хімічних лабораторіях гідроген хлорид одержують шляхом нагрівання натрій хлориду з концентрованою сульфатною кислотою.
Демонструється установка, учні записують на дошці рівняння реакції:
2NaCl + H2SO4  Na2SO4 + 2HCl
Na2SO4 + 2HCl
Згадайте, як необхідно збирати гідроген хлорид НСl? (Газ важчий за повітря, тому збирають, опустивши газовідвідну трубку в суху посудину)
У промисловості хлороводень синтезують із водню та хлору.
2. Хлоридна кислота
Лабораторний дослід 3. Хімічні властивості хлоридної кислоти
Дослід 1. Дослідження розчину хлоридної кислоти індикатором
HCl  H+ + Cl-
H+ + Cl-
Висновок: хлоридна кислота – безоксигенова одноосновна кислота, сильний електроліт.
Дослід 2. Взаємодія хлоридної кислоти з металами
Zn + 2Hd  ZnCl2 + H2
ZnCl2 + H2
Взаємодія хлоридної кислоти із цинк оксидом:
ZnО + 2HCl  ZnCl2 + H2О
ZnCl2 + H2О
Дослід 3. Реакція нейтралізації
Завдання. Проведіть реакцію нейтралізації в присутності фенолфталеїну, запишіть рівняння реакції в іонно-молекулярній формі:
NaОH + HCl  NaCl + H2О
NaCl + H2О
Дослід 4. Якісна реакція на хлорид-іон
Майже всі хлориди розчиняються у воді. До практично нерозчинних хлоридів належить аргентум хлорид. Він випадає у вигляді сирнистого осаду білого кольору в результаті додавання розчину аргентум нітрату до розчину, що містить хлорид-іон.
У двох пробірках містяться розчини хлоридної кислоти та натрій хлориду. Дослідіть розчини на наявність хлорид-іонів, запишіть іонно-молекулярні рівняння реакції:
Ag+ + Cl –  AgCl
AgCl
У результаті додавання до осаду нітратної кислоти осад не розчиняється: аргентум хлорид не розчиняється ні у воді, ні в кислотах. На світлі аргентум хлорид поступово чорніє, тому що розкладається на хлор і металеве срібло, що виділяється у вигляді дуже тонкого темно-сірого порошку.
3. Застосування хлоридної кислоти
Учитель пропонує учням з допомогою підручника або інших довідкових джерел розповісти про застосування хлоридної кислоти.
ІV. Застосування отриманих знань. Самостійна робота
Завдання 1. З якою з перелічених нижче речовин реагуватиме хлоридна кислота? Напишіть рівняння можливих реакцій.
Варіант І
А) магній;
Б) кальцій оксид;
В) ртуть;
Г) калій гідроксид.
Варіант ІІ
А) Срібло;
Б) купрум(ІІ) оксид;
В) алюміній;
Г) натрій гідроксид.
Завдання 2. Здійсніть перетворення.
Варіант І
Cl2  NaCl
NaCl  HCl
HCl  MgCl2
MgCl2
Варіант ІІ
Cl2  HCl
HCl  NaCl
NaCl  AgCl
AgCl
Завдання 3. Розв’яжіть задачі.
Варіант І
Обчисліть об’єм водню (н. у.), що виділиться внаслідок взаємодії 130 г цинку з 200 г розчину хлоридної кислоти з масовою часткою кислоти 27 %.
Варіант ІІ
Обчисліть об’єм гідроген хлориду (н. у.), одержаного шляхом взаємодії 117 г натрій хлориду з концентрованою сульфатною кислотою масою 150 г (масова частка кислоти – 60 %).
V. Підбиття підсумків уроку
1) Чим відрізняються властивості сполук Гідрогену з Хлором, Сульфуром, Нітрогеном, Карбоном?
2) Чому гідроген хлорид добре розчиняється у воді, а метан – ні?
3) Які хімічні властивості хлоридної кислоти доводять її приналежність до класу кислот?
4) Як визначити наявність аніонів Cl – у розчині?
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
