Ступінь електролітичної дисоціації – Електролітична дисоціація
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
6.6. Електролітична дисоціація
6.6.3. Ступінь електролітичної дисоціації
Розчини можуть складатись із частинок розчинника, розчиненої речовини і продуктів їхньої взаємодії, а отже, у розчинах електролітів можуть дисоціювати не всі, а лише частина молекул. Кількісною характеристикою процесу дисоціації є ступінь дисоціації (вимірюється в 0,1 М водному розчині).
Ступінь дисоціації а (“альфа”) –
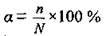
За цим показником електроліти поділяють на сильні, середньої сили та слабкі.
Сильні електроліти дисоціюють значною мірою (α > 30 %) навіть у концентрованих розчинах. До них належать:
А) більшість неорганічних кислот (H2SО4, HNO3, НСlO4, НСlO3, НСl, НВr, НІ, НМnO4);
Б) луги (гідроксиди лужних і лужноземельних металічних елементів);
В) розчинні солі:
– усі солі з катіонами лужних металічних елементів і з катіонами амонію NH4+;
– майже всі
– нітрати і нітрити всіх металічних елементів.
Електроліти середньої сили (α = 3-30 %)1: Н3РO4, H2SO3.
Слабкі електроліти дисоціюють частково (α < 3 %) навіть у розбавлених розчинах. До них належать:
А) майже всі органічні кислоти;
Б) деякі неорганічні кислоти (HF, НСlO, HNO2, Н3РО3), частина з яких є леткими (Н2СO3, H2S);
В) основи – мало – і нерозчинні у роді гідроксиди металів, амоній гідроксид NH4OH, а також вода Н2O;
Г) малорозчинні солі (BaSO4, CaSO4).
Ступінь електролітичної дисоціації речовини залежить від її природи, природи розчинника, концентрації та температури розчину. При зниженні концентрації електроліту, тобто при розбавленні розчину, ступінь дисоціації підвищується, тому що збільшується відстань між йонами в розчині, внаслідок чого зменшується можливість сполучення їх у молекули. При підвищенні температури ступінь дисоціації, як правило, теж підвищується.
Related posts:
- Ступінь дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.9. Ступінь дисоціації Оскільки електролітична дисоціація – процес оборотний, то в розчинах електролітів поряд з їх іонами є й молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається грецькою буквою “альфа” а). Ступінь дисоціації – це […]...
- Основні положення теорії електролітичної дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.2. Основні положення теорії електролітичної дисоціації 1. Електроліти під час розчинення у воді розпадаються (дисоціюють) на йони. У розчинах чи розплавах електролітів йони рухаються хаотично. 2. Під дією електричного поля (різниці потенціалів) рух йонів набуває спрямованості: […]...
- Механізми електролітичної дисоціації у водному розчині – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація Залежно від своєї природи речовини по-різному розчиняються у воді. Речовини з атомними кристалічними гратками є надзвичайно стійкими і у воді не розчиняються. Багато речовин з молекулярними кристалічними гратками (з неполярним ковалентним зв’язком) розчиняється у воді, розпадаючись […]...
- Ступінь дисоціації. Сильні та слабкі електроліти Тема 1 РОЗЧИНИ Урок 13 Тема уроку. Ступінь дисоціації. Сильні та слабкі електроліти Цілі уроку: розширити знання учнів про електроліти; ознайомити з поняттями “сильні та слабкі електроліти”; показати кількісну характеристику процесу електролітичної дисоціації – ступінь дисоціації; закріпити навички складання рівнянь дисоціації кислот, основ і солей; визначити відмінності сильних і слабких електролітів. Тип уроку: комбінований урок […]...
- Константа дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.4. Константа дисоціації Як уже згадувалось, дисоціація – процес оборотний: паралельно з розщепленням молекул на йони відбуваються процеси сполучення йонів у молекули – асоціація. Під час дисоціації слабких електролітів, наприклад нітритної кислоти, у певний момент встановлюється […]...
- Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.7. Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації Згідно з теорією електролітичної дисоціації, кислоти – це сполуки, які дисоціюють на катіони Гідрогену1 та аніони кислотного залишку: Як уже згадувалось, багатоосновні кислоти дисоціюють ступінчасто. Основність кислоти визначається […]...
- Електролітична дисоціація – Розчини Хімія Загальна хімія Розчини Електролітична дисоціація Речовини, розчини або розплави яких проводять електричний струм, називаються електролітамИ. Речовини, розчини або розплави яких не проводять електричного струму, називаються неелектролітамИ. Розпад електролітів на йони під час їхнього розчинення у воді називається електролітичною дисоціацієЮ. Основні положення теорії електролітичної дисоціації 1) Електроліти під час розчинення у воді розпадаються (дисоціюють) на […]...
- Сильні та слабкі електроліти – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Сильні та слабкі електроліти Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі – частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, […]...
- Теорія електролітичної дисоціації. Іонні реакції I СЕМЕСТР ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.) УРОК 3 Тема уроку. Теорія електролітичної дисоціації. Іонні реакції Цілі уроку: актуалізувати знання учнів про процеси, що протікають у розчинах; узагальнити знання про електролітичну дисоціацію речовин; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних рівнянь реакцій. Тип уроку: повторення й систематизації знань. Форми […]...
- Тема 12. Електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Тема 12. Електролітична дисоціація Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть речовину, за допомогою якої можна визначити сульфат-іони у розчині: A. Калій перманганат; Б. Лакмус; B. Барій нітрат; Г. Купрум(ІІ) гідроксид. 2. Позначте іони, що знаходяться […]...
- Електроліти та електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Електроліти та електролітична дисоціація Усі речовини можна розділити на електроліти та неелектроліти. Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Розчини й розплави неелектролітів електричний струм не проводять. До електролітів відносять речовини з іонною будовою, а також речовини […]...
- Теорія електролітичної дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.5. Теорія електролітичної дисоціації Для пояснення особливостей водних розчинів електролітів шведський учений С. Арреніус у 1887 р. запропонував теорію електролітичної дисоціації. Пізніше вона була розвинута багатьма вченими на основі вчення про будову атомів і хімічний […]...
- Електролітична дисоціація кислот, основ, солей у водних розчинах Тема 1 РОЗЧИНИ Урок 12 Тема уроку. Електролітична дисоціація кислот, основ, солей у водних розчинах Цілі уроку: поглибити знання учнів про електролітичну дисоціацію на прикладі розчинів кислот, основ і солей; формувати навички складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей; уточнити визначення кислот, основ і солей у світлі теорії електролітичної дисоціації. Тип уроку: засвоєння […]...
- Електролітична дисоціація. Електроліти й неелектроліти Тема 1 РОЗЧИНИ Урок 11 Тема уроку. Електролітична дисоціація. Електроліти й неелектроліти Цілі уроку: формувати уявлення учнів про процеси, що відбуваються в розчинах; ознайомити з поняттям “електролітична дисоціація”; пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника; ознайомити учнів з поділом речовин на електроліти й неелектроліти за електропровідністю в розчині або розплаві. Тип […]...
- Тема 11. Розчини – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Тема 11. Розчини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте речовину, що не розчинна у воді: A. Калій бромід; Б. Аргентум нітрат; B. Кальцій фосфат; Г. Натрій сульфат. 2. Вкажіть символ, яким позначається масова частка речовини: […]...
- Іонні рівняння реакцій – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Іонні рівняння реакцій Оскільки електроліти в розчинах утворюють іони, то для відображення змісту реакцій часто використовують так звані іонні рівняння, тому що в розчинах відбуваються реакції не між молекулами, а між іонами. Реакції, чиїм змістом є обмін іонами між реагентами, називають […]...
- Чисельне вираження складу розчинів – РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.1. Чисельне вираження складу розчинів У природі й техніці розчини мають величезне значення. Рослини засвоюють речовини у вигляді розчинів. Засвоєння їжі пов’язане з переходом поживних речовин у розчин. Усі природні води є розчинами. Розчинами є […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Механізм дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.6. Механізм дисоціації Суттєвим є питання про механізм електролітичної дисоціації. І дійсно, чому електроліти дисоціюють на іони? Вчення про хімічний зв’язок атомів допомагає відповісти на це запитання. Найлегше дисоціюють речовини з іонним зв’язком. Як відомо, […]...
- ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ – СТРУМ В ЕЛЕКТРОЛІТАХ Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 3. ЕЛЕКТРИЧНИЙ СТРУМ У РІЗНИХ СЕРЕДОВИЩАХ 3.2. СТРУМ В ЕЛЕКТРОЛІТАХ Електроліти – це водні розчини солей, кислот і основ, а також їхні розплави, у яких носіями струму є йони. Наприклад, де розчин NаСl, СuSO4, розплав NаОН. 3.2.1. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ При розчиненні солей, кислот і основ у воді іонний […]...
- Дисоціація води. Водневий показник ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.8. Дисоціація води. Водневий показник Хімічно чиста вода дуже слабо проводить електричний струм. Провідність зумовлена дисоціацією: За температури 25 °С ступінь дисоціації води а = 1,8 · 10-9. Оскільки 1 л води (1000 г) містить 55,56 моль речовини, концентрації […]...
- Дисоціація води – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.12. Дисоціація води. pH Водa і як слабкий електроліт незначною мірою дисоціює на іони Н+ і ОН-, що перебувають у рівновазі з недисоційованими молекулами: Н2O ⇆ Н+ + ОН-. Концентрацію іонів звичайно виражають у молях […]...
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- СОЛІ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СОЛІ ЯК ЕЛЕКТРОЛІТИ При розчиненні у воді солі дисоціюють з утворенням позитивно заряджених іонів металу (або амонію NН4+) і негативно заряджених кислотних залишків. Ці іони і визначають поведінку солей у розчинах. Солі можуть взаємодіяти з кислотами: З лугами: З іншими солями: І тут, як і в усіх реакціях, які відбуваються […]...
- ОБОРОТНІ РЕАКЦІЇ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОБОРОТНІ РЕАКЦІЇ Реакція дисоціації води, рівняння якої наведено у попередньому параграфі, протікає незначною мірою. З кожного мільярда молекул води в ній беруть участь лише дві, тому концентрація кожного з іонів, які утворюються, мізерно мала (10-7 моль/л). Коли кажуть, що вода – слабкий електроліт, то мають на увазі, що вона слабко […]...
- СТУПІНЬ ОКИСНЕННЯ ЕЛЕМЕНТА Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК СТУПІНЬ ОКИСНЕННЯ ЕЛЕМЕНТА Під ступенем окиснення розуміють позитивне або негативне число, що приписують елементу в сполуці. Ступінь окиснення елемента у простій речовині дорівнює нулю. У складній сполуці позитивний ступінь окиснення має менш електронегативний елемент; негативний ступінь окиснення проявляє більш електронегативний елемент. Алгебрична сума ступенів окиснення атомів у […]...
- Реакції обміну між розчинами електролітів, умови їх протікання Тема 1 РОЗЧИНИ УРОК 14 Тема уроку. Реакції обміну між розчинами електролітів, умови їх протікання Цілі уроку: показати процеси, що протікають у розчинах електролітів як реакції обміну між іонами; ознайомити з умовами їх протікання; формувати навички складання іонних рівнянь. Тип уроку: формування вмінь і навичок та їх творчого застосування. Форми роботи: розповідь учителя, демонстраційний експеримент, […]...
- Ступінь окиснення ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.9. Ступінь окиснення Для запису окисно-відновних реакцій користуються поняттям ступеня окиснення. Ступінь окиснення – це умовна величина заряду атома елемента, яка визначається з припущення, що речовина має йонний тип хімічного зв’язку, тобто спільна електронна пара повністю належить атому більш електронегативного […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп Цілі уроку: формувати знання учнів про хімічні властивості одноосновних карбонових кислот; показати взаємний вплив карбоксильної групи та […]...