Теорія будови атома – Періодичний закон та теорія будови атома
Хімія
Загальна хімія
Періодичний закон та теорія будови атома
Теорія будови атома
Атом – це електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Будова атомних ядер
Ядра атомів Складаються з елементарних частинок двох видів: протонів (p) і нейтронів (n). Сума протонів і нейтронів у ядрі одного атома називається нуклонним числом:
 ,
,
де А – нуклонне число, N – число нейтронів, Z – число протонів.
Протони мають позитивний заряд
Число позитивно заряджених протонів у ядрі дорівнює числу негативно заряджених електронів, тобто атом у цілому електронейтральний.
Атоми з однаковим зарядом ядра складають хімічний елемент.
Атоми різних елементів називаються нуклідами.
Ізотопи – атоми одного й того ж елемента, які мають різне нуклонне число внаслідок різної кількості
Ізотопи Гідрогену
| Назва | A | Z | N |
| Протій Н | 1 | 1 | 0 |
| Дейтерій D | 2 | 1 | 1 |
| Тритій T | 3 | 1 | 2 |
Радіоактивний розпад
Ядра нуклідів можуть розпадатися з утворенням ядер інших елементів, а також  ,
,  або інших частинок.
або інших частинок.
Спонтанний розпад атомів деяких елементів називається радіоактивністЮ, а такі речовини – радіоактивнимИ. Радіоактивність супроводжується випусканням елементарних частинок і електромагнітних хвиль – випромінюванняМ.
Рівняння ядерного розпаду – ядерні реакції – записуються таким чином:

Час, за який розпаду піддається половина атомів даного нукліда, називається періодом піврозпаду  .
.
Елементи, що складаються тільки з радіоактивних ізотопів, називаються радіоактивнимИ. Це елементи з  61 і 84-107.
61 і 84-107.
Види радіоактивного розпаду
1)  -розпаД. Випромінюються
-розпаД. Випромінюються  -частинки, тобто ядра атома Гелію
-частинки, тобто ядра атома Гелію  . При цьому нуклонне число ізотопу зменшується на 4, а заряд ядра на 2 одиниці, наприклад:
. При цьому нуклонне число ізотопу зменшується на 4, а заряд ядра на 2 одиниці, наприклад:

2)  -розпаД. У нестійкому ядрі нейтрон перетворюється на протон, при цьому ядро випромінює електрони та антинейтрино. Під час
-розпаД. У нестійкому ядрі нейтрон перетворюється на протон, при цьому ядро випромінює електрони та антинейтрино. Під час  -розпаду нуклонне число не змінюється, а заряд ядра збільшується на 1, наприклад:
-розпаду нуклонне число не змінюється, а заряд ядра збільшується на 1, наприклад:

3)  -розпаД. Збуджене ядро випромінює
-розпаД. Збуджене ядро випромінює  -промені з дуже малою довжиною хвилі, при цьому енергія ядра зменшується, нуклонне число і заряд ядра не змінюються, наприклад:
-промені з дуже малою довжиною хвилі, при цьому енергія ядра зменшується, нуклонне число і заряд ядра не змінюються, наприклад:

Будова електронних оболонок атомів елементів перших трьох періодів
Електрон має двоїсту природу: він може поводитися і як частинка, і як хвиля. Електрон у атомі не рухається за певними траєкторіями, а може перебувати в будь-якій частині навколо ядерного простору, проте ймовірність його перебування в різних частинах цього простору неоднакова. Простір навколо ядра, у якому найімовірніше перебування електрона, називається ОрбіталлЮ.
Кожний електрон у атомі перебуває на певній відстані від ядра відповідно до запасу його енергії. Електрони з більш-менш однаковою енергією формують енергетичні рівнІ, або електронні шарИ.
Число заповнених електронами енергетичних рівнів у атомі даного елемента дорівнює номеру періоду, в якому він розташований.
Число електронів на зовнішньому енергетичному рівні дорівнює номеру групи, вякій розміщений даний елемент.
У межах одного енергетичного рівня електрони можуть відрізнятися формою електронної хмарИ, або орбіталІ. Існують такі форми орбіталей:
s-форма:
p-форма: 
Існують також d-, f-орбіталі та інші, зі складнішою формою.
Електрони з однаковою формою електронної хмари утворюють однойменні енергетичні підрівнІ: s-, p-, d-, f-підрівні.
Кількість підрівнів на кожному енергетичному рівні дорівнює номеру цього рівня.
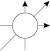
У межах одного енергетичного підрівня можливий різний розподіл орбіталей у просторі. Так, у тривимірній системі координат для s-орбіталі можливе тільки одне положення:
для р-орбіталі – три:
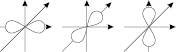
для d-орбіталі – п’ять, для f-орбіталі – сім.
Орбіталі зображують:
s-підрівень –
p-підрівень –
d-підрівень –
Електрон на схемах позначається стрілкою, яка вказує його спін. Під спіном розуміють обертання електрона навколо своєї осі. Він позначається стрілкою:  або
або  . Два електрони на одній орбіталі записуються
. Два електрони на одній орбіталі записуються  , але не
, але не  .
.
Більше двох електронів на одній орбіталі перебувати не може (Принцип Паулі).
Принцип найменшої енергіЇ: В атомі кожний електрон розташовується так, щоб його енергія була мінімальною (що відповідає його найбільшому зв’язку з ядром).
Наприклад, розподіл електронів в атомі ХлорУ:
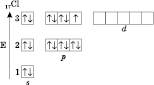
Один неспарений електрон визначає валентність Хлору в такому стані – I.
Під час отримання додаткової енергії (опромінення, нагрівання) можливе розпарування електронів (промотування). Такий стан атома ще називається збуджениМ. При цьому кількість неспарених електронів збільшується і, відповідно, змінюється валентність атома.
Збуджений стан атома ХлорУ:
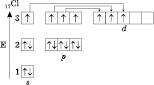
Відповідно до числа неспарених електронів Хлор може мати валентність III, V і VII.