Визначення середньої молярної маси суміші газів – Приклади розв’язування типових задач
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
1. Основні хімічні поняття. Речовина
Приклади розв’язування типових задач
V. Визначення середньої молярної маси суміші газів
Формули і поняття, які використовуються:

Де М(суміші) – середня молярна маса суміші газів,
М(А), М(Б), М(В) – молярні маси компонентів суміші А, Б і В,
Χ(А), χ(Б), χ(В) – мольні частки компонентів суміші А, Б і В,
Φ(А), φ(Б), φ(В) – об’ємні частки компонентів суміші
М(пов.) – молярна маса повітря, г/моль,
Мr(пов.) – відносна молекулярна маса повітря.
Задача 23. Обчисліть молярну масу суміші, у якій об’ємні частки метану і бутану відповідно становлять 85 і 15%.
Дано:
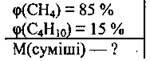
Розв’язання
Молярна маса суміші – це маса всіх її складових, узятих у сумарній кількості речовини суміші 1 моль (М(СН4) = 16 г/моль, М(С4Н10) = 58 г/моль). Обчислити середню молярну масу суміші можна за формулою:
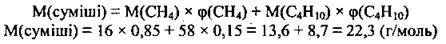
Відповідь: М(суміші) = 22,3 г/моль.
Задача 24. Визначте густину газової суміші за азотом, у якій об’ємні частки карбон(ІV)
Дано:
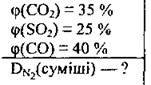
Розв’язання
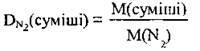
1. Обчислимо молярну масу суміші (М(СO2) = 44 г/моль, M(SO2) = 64 г/моль, М(СО) = 28 г/моль):
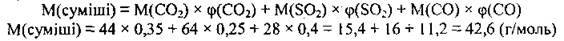
2. Обчислимо відносну густину суміші за азотом:
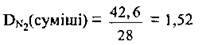
Відповідь: DN2(суміші) = 1,52.
Задача 25. Густина суміші ацетилену і бутену за гелієм дорівнює 11. Визначте об’ємну частку ацетилену в суміші.
Дано:
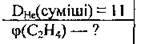
Розв’язання
1. За формулою 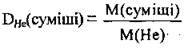 визначимо молярну масу суміші (М(Не) = 4 г/моль):
визначимо молярну масу суміші (М(Не) = 4 г/моль):
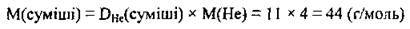
2. Припустимо, що ми маємо 1 моль суміші. У ній міститься х моль С2Н2, тоді відповідно
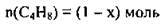
3. Запишемо вираз для обчислення середньої молярної маси газової суміші:
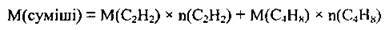
Підставимо всі відомі дані: М(С2Н2) = 26 г/моль, М(С4Н8) = 56 г/моль:
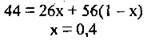
4. Отже, 1 моль суміші містить 0,4 моль С2Н2. Обчислимо мольну частку χ(С2Н2):
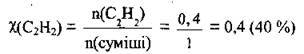
Для газів φ(Х) = χ(Х). Отже, φ(С2Н4) = 40 %.
Відповідь: φ(С2Н4) = 40 %.
Related posts:
- Визначення масової та об’ємної часток компонента в суміші – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач IV. Визначення масової та об’ємної часток компонента в суміші Формули і поняття, які використовуються: Де w(X) – масова частка цього компонента в суміші, Φ(Х) – об’ємна частка компонента X в суміші, M(X) – маса […]...
- Обчислення відносної густини газу – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач III. Обчислення відносної густини газу Формули і поняття, які використовуються: Де Dnов.(X) – відносна густина газу X за повітрям, DA(X) – відносна густина газу X за газом А, М(Х) – молярна маса газу X, […]...
- Розрахунки за формулами для обчислення кількості речовини – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач І. Розрахунки за формулами для обчислення кількості речовини Формули і поняття, які використовуються: Де n(Х) – кількість речовини X, моль, M(Х) – маса речовини X, г, V(X) – об’єм газу X за нормальних умов, […]...
- Приклади розв’язування типових задач – Урок 8 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Обчисліть масову частку калій гідроксиду (%) в розчині, одержаному при розчиненні 0,75 моль калій оксиду в 180 мл води. Дано: Розв’язання 1. Складемо рівняння реакції і, склавши пропорцію, розрахуємо кількість речовини лугу n(КОН), […]...
- Виведення формули сполуки – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач VI. Виведення формули сполуки Зауважимо, що співвідношення значень індексів у формулі речовини дорівнює співвідношенню кількості атомів елементів у сполуці та відповідно співвідношенню кількостей речовини елементів. Отже, для речовини, формула якої Р2O5, можна записати: Якщо […]...
- Приклади розв’язування типових задач – Урок 6 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. У розчині, маса якого 400 г, міститься 25 г натрій хлориду. Обчисліть масову частку натрій хлориду (%) в розчині. Дано: Розв’язання Відповідь: w(NaCl) = 6,25 %. Задача 2. Натрій гідроксид, маса якого 10 […]...
- Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач II. Розрахунки за рівняннями хімічних реакцій Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду? Дано: Розв’язання Запишемо рівняння реакції: 1. З написаного рівняння видно, що 2. Для знаходження об’єму водню […]...
- Визначення молярної маси – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 1.3 . Визначення молярної маси У газах і рідинах, що легко випаровуються, використовують основну залежність, яка полягає в тому, що 1 моль речовини в газоподібному стані за нормальних умов займає об’єм V = 22,4 літра. Зважена порція речовини леткої рідини випаровується, а об’єм газу, який утворився, вимірюють за наявної температури і тиску, […]...
- Приклади розв’язування типових задач – Урок 2 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома Приклади розв’язування типових задач Задача 1. Укажіть протонне число елемента, в атомі якого міститься на 4 електрони менше, ніж у йоні Аl3+. Розв’язання Іон Аl3+ утворюється в результаті віддачі атомом Алюмінію трьох електронів: Елемент E має (10 – 4 =) […]...
- Обчислення за хімічними формулами молярної маси й кількості речовини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 6 Тема. Обчислення за хімічними формулами молярної маси й кількості речовини Цілі уроку: поглибити уявлення учнів про молярну масу речовини; навчити використовувати набуті знання для обчислення за хімічними формулами молярної маси, маси й кількості речовини. Тип уроку: формування вмінь і навичок. Форми роботи: керована практика, самостійна […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Розв’язування типових задач Метали та сплави – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП §14.10. Розв’язування типових задач Метали та сплави Задача 1. Відновлюючи вугіллям сполуку Fe(CrO2)2 (хромистий залізняк), добувають сплав ферохром, який використовують у металургії. Визначте масову частку хрому в цьому сплаві, вважаючи, що інших компонентів, крім феруму та хрому, […]...
- Відносна густина газів. Обчислення відносної густини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 8 Тема. Відносна густина газів. Обчислення відносної густини Цілі уроку: розкрити суть поняття “відносна густина газів”; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків. Тип уроку: засвоєння нових знань. Форми роботи: розповідь учителя, керована практика, […]...
- Обчислення масової частки елемента в сполуці – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач II. Обчислення масової частки елемента в сполуці Формули і поняття, які використовуються: Де w(E) – масова частка елемента Е в сполуці, Аr(Е) – відносна атомна маса елемента Е, N(E) – кількість частинок (атомів, іонів) […]...
- Приклади розв’язування типових задач – Урок 7 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Складіть молекулярне рівняння, що відповідає такому скороченому йонно-молекулярному рівнянню: Розв’язання Йонно-молекулярне рівняння реакції показує, що під час реакції відбулось зв’язування йонів Купруму Сu2+ і сульфід-іонів S2- в нерозчинну сполуку купрум(ІІ) сульфід CuS, тобто […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.8. Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях Італійський учений А. Авогадро звернув увагу на те, що всі гази однаково стискуються (закон Бойля – Маріотта1), мають однаковий термічний коефіцієнт розширення (закон Гей-Люссака2) та деякі інші […]...
- Моль. Молярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.6. Моль. Молярна маса У Міжнародній системі одиниць (Сl) за одиницю кількості речовини прийнято моль. Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься […]...
- Приклади розв’язування типових задач – Урок 3 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Приклади розв’язування типових задач Задача 1. Укажіть кількість р-електронів, які утворюють хімічні зв’язки у молекулі хлор(І) оксиду. Розв’язання Сl2O. Будова електронних оболонок елементів Хлору і Оксигену: З формули видно, що Хлор перебуває в основному (незбудженому) стані та виявляє валентність І. […]...
- Розв’язування типових задач – АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 18. АЗОТОВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 18.7. Розв’язування типових задач Задача 1. Як можна добути анілін, виходячи з метану і не використовуючи інші органічні сполуки? Зазначте умови перебігу реакцій. Розв’язання. Проводячи піроліз метану, можна добути ацетилен: T 2СН4 -> С2Н2 + ЗН2. […]...
- Розв’язування розрахункових задач на виведення формули органічної речовини Хімія Органічна хімія Вуглеводні Розв’язування розрахункових задач на виведення формули органічної речовини Задача. Визначте істинну формулу вуглеводню, при спалюванні 4,4 г якого одержали 13,2 г карбон(IV) оксиду і 7,2 г води. Відносна густина парів вуглеводню за воднем дорівнює 22. Розв’язання I спосіб 1) Напишемо рівняння реакції: . 2) Із рівняння реакції видно, що всі атоми […]...
- Обчислення вмісту металів у їх суміші РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 60. Обчислення вмісту металів у їх суміші Усвідомлення змісту цього параграфа дає змогу: Розв’язувати задачі даного типу. Задачі на обчислення вмісту металів у суміші (спрощено – “задачі на суміші”) є різновидом задач, пов’язаних з обчисленням за рівнянням реакції. Уміст компонента (A) […]...
- Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Цілі уроку: формувати знання учнів про закон об’ємних співвідношень для газоподібних речовин на прикладі хімічних реакцій органічних речовин; формувати вміння застосовувати закон об’ємних співвідношень для розрахунків за хімічними рівняннями. Тип уроку: формування нових […]...
- Молярна маса Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 5 Тема. Молярна маса Цілі уроку: увести поняття “молярна маса”; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв’язок між кількістю речовини, масою, молярною масою. Тип уроку: комбінований. Форми роботи: керована практика, самостійна робота. Обладнання: Періодична система хімічних елементів Д. […]...
- Розв’язування типових задач Масова частка розчиненої речовини – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.14. Розв’язування типових задач Масова частка розчиненої речовини Задача 1. Потрібно приготувати розчин масою 320 г з масовою часткою хлориду калію 3%. Розрахуйте масу КСl і масу води, які необхідні для приготування розчину. Розв’язання. Обчислюємо […]...
- Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 37 Тема. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Цілі уроку: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними; підготувати учнів до тематичного оцінювання. Тип […]...
- Кількість речовини. Стала Авогадро. Молярна маса Хімія Загальна хімія Основні поняття, закони й теорії хімії Кількість речовини. Стала Авогадро. Молярна маса Кількість речовини (n) – це визначене число будь-яких структурних одиниць (атомів, молекул, іонів тощо). Одиниця виміру кількості речовини – Моль. В 1 моль число будь-яких частинок дорівнює , тобто стільки ж, скільки міститься в 0,012 кг вуглецю. Це число визначене […]...
- Вправа 195-204 № 195. Відповідь: m(р. р.) = 6 г. № 196. Дано: Розв’язання 1. Обчислимо m розчину: 2. Обчислимо масову частку розчиненої речовини: Відповідь: ω(цукру) = 0,2 або 20 %. № 197. M (р-ну), г M (р. р.), г M (води), г ω(р. р.) 400 8 392 0,02 або 2 % 500 40 460 0,08 або […]...
- Обчислення масової частки й маси речовини в розчині Тема 1 РОЗЧИНИ Урок 8 Тема уроку. Обчислення масової частки й маси речовини в розчині Цілі уроку: закріпити знання про масову частку розчиненої речовини; формувати навички й уміння обчислювати масову частку розчиненої речовини, застосовувати ці знання для обчислення маси розчиненої речовини, приготування розчинів із заданою масовою часткою розчиненої речовини. Тип уроку: застосування знань, умінь і […]...
- Розрахунки за рівняннями хімічних реакцій між розчином солі та металом РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 53. Розрахунки за рівняннями хімічних реакцій між розчином солі та металом Усвідомлення змісту цього параграфа дає змогу: Пояснювати суть і причини зміни маси пластинки в зазначених реакціях; Розв’язувати задачі “на пластинку”. Задачі такого типу засновані на закономірностях витискувального ряду металів. Як ви уже знаєте, показником порівняльної хімічної […]...