Хімічні властивості альдегідів – АЛЬДЕГІДИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ОРГАНІЧНА ХІМІЯ
АЛЬДЕГІДИ
Хімічні властивості альдегідів
1. Горіння. Як і більшість органічних сполук, альдегіди добре горять на повітрі з утворенням вуглекислого газу й води. Причому зі збільшенням вуглеводневого радикала збільшується кількість молекул альдегідів, які горять із утворенням вуглецю (сажі) та води.
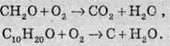
2. Гідрування. Гідрування альдегідів проходить у присутності каталізаторів (Ni, Рt, Рd тощо).
Більш важливо розглянути цю властивість із погляду окисно-відновних реакцій. Оскільки в органічних сполуках атоми Карбону можуть виявляти різні ступені окиснення, то слід виходити з того, що в атомів Гідрогену ступінь окиснення завжди +1, а в Оксигену – -2:
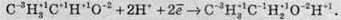
Атом Карбону, який входив до альдегідної групи, змінює ступінь окиснення за рахунок прийому двох електронів, отже, він відновився. Із цього можна зробити висновок, що спирт – це відновлений альдегід і навпаки: альдегід – це окиснений спирт. Отже, процес приєднання молекули водню альдегідами – це окисно-відновний
3. Окиснення альдегідів (реакція срібного дзеркала). Унаслідок наявності надлишкового позитивного заряду на карбоновому атомі електронна густина, що зв’язує його з атомом Гідрогену, трохи зміститься до Карбону й атом набуде більшої реакційної здатності (цей зсув, однак, не такий значний, аби міг встановлюватися міцний водневий зв’язок між молекулами альдегіду).
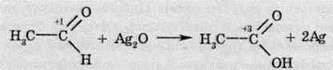
У цій реакції атом Карбону альдегідної групи віддає два електрони, отже, реакція з аргентум оксидом також є окисно-відновною, однак у цьому разі альдегід уже підлягає окисненню. І якщо результатом відновлення альдегідів є спирти, то внаслідок окиснення утворюються карбонові кислоти.
Окиснення альдегідів купрум(ІІ) гідроксидом.
Аналогічно до аргентум оксиду купрум(ІІ) гідроксид здатний окиснювати альдегіди. При цьому утворюється жовтий осад одновалентного купрум(І) гідроксиду:
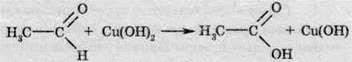
При подальшому нагріванні відбувається розклад купрум(І) гідроксиду й утворення червоного осаду одновалентного купрум(І) оксиду:
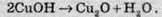
4. Поліконденсація. Ненасичені вуглеводні вступають у реакцію полімеризації, унаслідок якої велика кількість молекул ненасичених сполук здатні з’єднуватися один з одним і утворювати досить довгі ланцюги, як, наприклад, у результаті полімеризації етилену утворюється поліетилен. Аналогічним способом можуть з’єднуватися молекули формальдегіду з молекулами фенолу, утворюючи в такий спосіб молекулу полімеру. У результаті цієї реакції, крім високомолекулярної сполуки (смоли), утворюється також низькомолекулярна (вода). Цим реакція поліконденсації відрізняється від полімеризації.
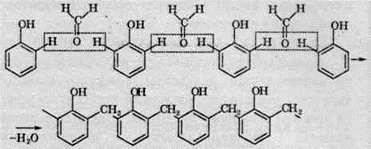
5. Гідратація. При вивченні хімічних властивостей ненасичених вуглеводнів розглядалися реакції приєднання за кратним зв’язком складних сполук з полярними ковалентними зв’язками в молекулі (НСl, Н2O). Природно припустити, що подібні реакції можливі і в альдегідів, тим більше, що хімічний зв’язок у карбонільній групі вже поляризований і ніби готовий до приєднання речовин з полярними зв’язками, тому у водних розчинах відбувається така реакція:
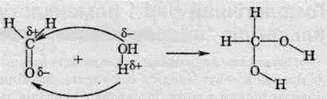
У випадку формальдегіду ця оборотна реакція суттєво зміщена вправо, унаслідок чого він існує в розчині переважно в гідратній формі (99,9%). У цьому разі до позитивно зарядженого атома Карбону карбонільної групи приєднується гідроксильна група за допомогою вільної електронної пари атома Оксигену; електрони π-зв’язку повністю переходять до атома Оксигену й за допомогою них до нього приєднується протон.
6. Утворення напівацеталей та ацеталей зі спиртами. Подібним чином альдегіди реагують з одноатомними спиртами, адже спирти за типом своєї будови схожі на воду:
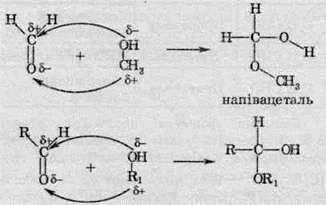
Подібна реакція може відбуватися у винах при довгому зберіганні, й утворюваний напівацеталь (а потім і ацеталь) надає додаткового аромату винам, оскільки ацеталі найчастіше являють собою речовини з приємним запахом (на відміну від альдегідів).
7. Приєднання синильної кислоти. Оскільки молекула синильної кислоти розпадається на iони, то приєднання проходить у такий спосіб:
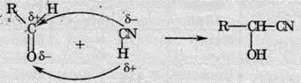
У результаті реакції утворюються нітрили спиртів.