Хлороводень і хлоридна кислота – ГАЛОГЕНИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ГАЛОГЕНИ
Хлороводень і хлоридна кислота
Атоми Гідрогену та Хлору зв’язані в молекулу хлороводню НСl полярним ковалентним зв’язком. Ступінь окиснення атома Хлору в цій сполуці дорівнює -1.
Хлороводень – безбарвний газ (Тпл = -114 °С, Ткип = -85 °С) з характерним різким запахом. У вологому повітрі “димить” за рахунок утворення туману з крапельок розчину хлороводню у воді. Дуже добре розчинний у воді – в одному об’ємі
Хімічні властивості хлороводню та хлоридної кислоти
Сухий хлороводень не взаємодіє з металами і не спричиняє їхньої корозії. Проте у присутності невеликих кількостей води активно кородує багато металів. Хлоридна кислота – сильна одноосновна кислота. У водному розчині повністю піддається дисоціації:
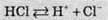
За рахунок обмеженої розчинності хлороводню у воді, максимальна концентрація хлоридної кислоти може дорівнювати 38 % (за 25 °С).
Хлоридна кислота енергійно взаємодіє з багатьма металами,
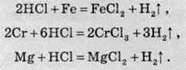
Хлоридна кислота взаємодіє з деякими окисниками з утворенням простої речовини хлору:
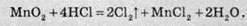
Хлороводень окислюється киснем у присутності каталізатора – купрум(ІІ) хлориду СuСl2:

Добування та застосування
Хлороводень у промислових масштабах добувають двома методами. Перший метод полягає у безпосередній взаємодії простих речовин хлору та водню внаслідок опромінювання світлом:

Другий метод грунтується на хімічній реакції між концентрованою сульфатною кислотою та кристалічним натрій хлоридом:
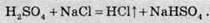
Практично весь хлороводень, який добувають у промисловості, використовують для добування хлоридної кислоти. Добуту кислоту транспортують у пластикових і скляних балонах або у вкритих із середини кислотостійкою речовиною сталевих балонах.
Хлоридну кислоту використовують для добування різних хлоридів металів. Солі хлоридної кислоти застосовують практично в будь-яких процесах. Наприклад, натрій хлорид NaCl застосовується як добавка до їжі, як сировина для добування хлору, натрій гідроксиду, хлоридної кислоти та багатьох інших речовин; барій хлорид ВаСl2 і меркурій(ІІ) хлорид HgCl2 – гарні інсектициди; безводні хлориди Алюмінію і Феруму АlСl3 і FeCl3 – дуже важливі в органічному синтезі каталізатори; титан(ІV) хлорид ТіСl4 – один з компонентів каталізатора Циглера – Натта для виробництва поліетилену; аргентум хлорид AgCl застосовується у фотографії.
Якісна реакція на хлорид-іон
Як реагент на хлорид-іон використовують розчин будь-якої солі Аргентуму, найчастіше нітрату. Якщо внаслідок додавання до досліджуваного розчину, утворюється білий, не розчинний у нітратній кислоті осад аргентум хлориду:
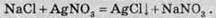
Якщо цей осад залишити на світлі, то він набуває сірого кольору, за рахунок фотохімічного розкладу аргентум хлориду:
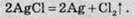
Якщо отримано такі результати, то можна зробити висновок про те, що в досліджуваному розчині містяться хлориди.