Хром – МЕТАЛИ ПОБІЧНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП
§ 14.2. Хром
Поширення у природі. Хром трапляється у вигляді сполук у різних мінералах. Найпоширеніший мінерал хроміт, або хромистий залізняк FeCr2O4, багаті родовища якого є на Уралі і в Казахстані. Загальний вміст хрому в земній корі становить 0,03%. Хром виявлено на Сонці, зірках і в метеоритах.
Добування. Металічний хром добувають відновленням оксиду хрому(ІІІ) при нагріванні з алюмінієм:
Сr2О3 + 2Аl = Аl2О3
Металічний хром добувають також електролізом водних розчинів сполук хрому.
Фізичні властивості. Хром – сірувато-білий блискучий метал. З металів він найтвердіший, його густина 7,2 г/см3, т. пл. 1 855°С. Природний хром складається із суміші п’яти ізотопів з масовими числами 50, 52, 53, 54 і 56. Радіоактивні ізотопи добуті штучно.
Хімічні властивості. Розміщення електронів на 3d – і 4s – орбіталях атома хрому можна представити схемою
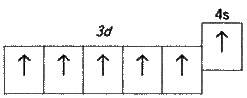
Звідси випливає, що хром може виявляти у сполуках різні ступені окиснення – від +1 до +6; з них найстійкіші сполуки
Хрому зі ступенями окиснення
На поверхні хрому, як і алюмінію, утворюється оксидна плівка Сr2О3. Тому хром у розведених сульфатній і хлоридній кислотах починає розчинятися не відразу, а після розчинення оксидної плівки:
Сr + 2Н+ = Сr2+ + Н2↑.
У нітратній і концентрованій сульфатній кислотах хром не розчиняється, оскільки його оксидна плівка зміцнюється, тобто хром переходить у пасивний стан. З цієї самої причини не взаємодіють з хромом розведені сульфатна і хлоридна кислоти, що містять розчинений кисень. Пасивацію хрому можна усунути очищенням поверхні металу. При високій температурі хром горить у кисні, утворюючи оксид Сr2О3. Розжарений хром реагує з парою води:
2Cr + 3H2PO ⇆ Сr2О3 + 3Н2↑.
Металічний хром при нагріванні реагує також з галогенами, галогеноводнями, сіркою, азотом, фосфором, вугіллям, кремнієм і бором. Наприклад:
Сr + 2HF = CrF2 + Н2↑; 2Cr + N2 = 2CrN;
2Cr + 3S = Cr2S; Cr + Si = CrSi.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Оксиди та гідроксиди хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.3. Оксиди та гідроксиди хрому Хром утворює три оксиди: СrО, Сr2О3 та СrО3. Оксид хрому(ІІ) СrО – пірофорний чорний порошок (пірофорність – здатність в тонкоподрібненому стані займатися на повітрі). Добувають його окисненням амальгами хрому киснем повітря. […]...
- Загальна характеристика підгрупи хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.1. Загальна характеристика підгрупи хрому До металів побічних підгруп періодичної системи Д. І. Менделєєва належать всі d-елементи. Таких підгруп 10: скандію, титану, ванадію, хрому, мангану, феруму, кобальту, ніколу, купруму та цинку. Тут розглядаються загальні характеристики підгрупи […]...
- Хромати і дихромати – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.4. Хромати і дихромати Хромові кислоти утворюють два ряди солей: хромати – так називаються солі хроматної кислоти – і дихромати – так називаються солі дихроматної кислоти. Хромати мають жовте забарвлення (колір хромат-іона Сr2-4 ), дихромати – […]...
- Розв’язування типових задач Метали та сплави – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП §14.10. Розв’язування типових задач Метали та сплави Задача 1. Відновлюючи вугіллям сполуку Fe(CrO2)2 (хромистий залізняк), добувають сплав ферохром, який використовують у металургії. Визначте масову частку хрому в цьому сплаві, вважаючи, що інших компонентів, крім феруму та хрому, […]...
- Залізо – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14. 6 . Залізо Найважливіші руди заліза. Залізо після алюмінію – найпоширеніший у природі метал. Загальний вміст його в земній корі становить 5,1 %. Залізо входить до складу багатьох мінералів. Найважливішими залізними рудами є: 1) магнітний […]...
- Сполуки заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.7. Сполуки заліза Для заліза найбільш характерні два ряди сполук: сполуки феруму(ІІ) і феруму(ІІІ). Відома також незначна кількість сполук феруму(VІ) – ферати, наприклад ферат калію K3FeO4, ферат барію BaFeO4. Оксид ферум у (II) FeO – чорний […]...
- Загальна характеристика родини заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.5. Загальна характеристика родини заліза У побічній підгрупі VIII групи періодичної системи елементів Д. І. Менделєєва розташовано 9 елементів: ферум, кобальт, нікол, рутеній, родій, паладій, осмій, іридій, платина. Подібні між собою елементи цієї групи утворюють горизонтальні […]...
- Чавун і сталі – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.9. Чавун і сталі Виплавлений у домні чавун містить феруму близько 93 %, карбону до 4,5 %, силіцію 0,5-2 %, мангану 1-3 %, фосфору 0,02-2,5 % і сульфуру 0,005-0,08 %. Чавун крихкий, не піддається куванню і […]...
- Алюміній – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.11. Алюміній Природні сполуки алюмінію. Алюміній належить до найпоширеніших елементів. Серед металів за поширенням у природі він посідає перше місце. Загальний вміст алюмінію в земній корі становить 8,8 %. Найважливіші природні сполуки алюмінію – алюмосилікати, боксит, […]...
- Доменний процес – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.8. Доменний процес Добування заліза з руд грунтується на відновленні його оксидів оксидом карбону(ІІ) та вугіллям (коксом). При цьому утворюється не чисте залізо, а сплав його з вугіллям та іншими домішками (кремнієм, марганцем, сіркою, фосфором). Цей […]...
- Кальцій – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.6. Кальцій Поширення у природі. Кальцій належить до поширених елементів. Загальний вміст його в земній корі становить 3,6 %. У природі найбільш розповсюджені такі сполуки кальцію: мінерал кальцит СаСО3 (з нього утворені масиви вапняку, мармуру і […]...
- Натрій і калій – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.2. Натрій і калій Поширення в природі. В природі лужні метали у вільному стані не трапляються. Натрій і калій входять до складу різних сполук. Найважливішою є сполука натрію з хлором NaCl, яка утворює поклади кам’яної солі […]...
- Оксид та гідроксид алюмінію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.12. Оксид та гідроксид алюмінію Оксид алюмінію (глинозем) Аl2О3 – речовина білого кольору, досить тугоплавка, з дуже високою твердістю. Є вихідним продуктом для добування алюмінію. У природі трапляється у вигляді корунду та його різновидів. Якщо безбарвні […]...
- Загальна характеристика підгрупи берилію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.5. Загальна характеристика підгрупи берилію Цю підгрупу складають берилій, магній і лужноземельні елементи (кальцій, стронцій, барій, радій). Деякі властивості цих елементів наведено в табл. 13.2. Таблиця 13.2. Властивості елементів підгрупи берилію Властивості Be Mg Са Sr […]...
- Загальна характеристика підгрупи бору – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.10. Загальна характеристика підгрупи бору Головну підгрупу III групи (підгрупу бору) складають елементи бор, алюміній, галій, індій і талій. Деякі властивості цих елементів наведено у табл. 13.3. Таблиця 13.3. Властивості елементів підгрупи бору Властивості В АІ […]...
- Загальна характеристика підгрупи літію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.1. Загальна характеристика підгрупи літію Підгрупу літію складають елементи: літій, натрій, калій, рубідій, цезій та францій. Деякі властивості цих елементів наведено в табл. 13.1. Це s-елементи (див. табл. 13.1, п. 2). Атоми на зовнішньому енергетичному рівні […]...
- Їдкі луги – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.3. Їдкі луги Їдкими лугами називаються добре розчинні у воді гідроксиди. Найважливіші з них NaOH та КОН. Гідроксид натрію і гідроксид калію – білі, непрозорі, тверді кристалічні речовини. У воді добре розчиняються з виділенням великої кількості […]...
- Застосування алюмінію та його сплавів – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.13. Застосування алюмінію та його сплавів Фізичні та хімічні властивості алюмінію зумовили його широке застосування в техніці. Значним споживачем алюмінію є авіаційна промисловість: літак на складається з алюмінію та його сплавів, а авіацшнии двигун – на […]...
- Солі кальцію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.8. Солі кальцію Карбонат кальцію широко розповсюджений в природі у вигляді гірської породи – вапняку. Багато гірських хребтів складаються з вапняку і крейди. Часто трапляється і мармур, що утворився у давні геологічні епохи з вапняку і […]...
- Оксид і гідроксид кальцію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.7. Оксид і гідроксид кальцію Оксид кальцію (технічні назви: негашене вапно, палене вапно, кипілка) – порошок білого кольору. У промисловості його добувають випалюванням вапняку, крейди чи інших карбонатних порід: СаСО3 = СаО + СО3; ∆Н° = […]...
- ФЕРУМ ЯК ПРЕДСТАВНИК МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ПОБІЧНИХ ПІДГРУП. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ЗАЛІЗА, СПОЛУКИ ФЕРУМУ(ІІ) ТА ФЕРУМУ(ІІІ) ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 13. ФЕРУМ ЯК ПРЕДСТАВНИК МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ПОБІЧНИХ ПІДГРУП. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ЗАЛІЗА, СПОЛУКИ ФЕРУМУ(ІІ) ТА ФЕРУМУ(ІІІ) Цілі: повторити положення в ПС, будову атома Феруму, способи добування, фізичні властивості сполук Феруму(ІІ) та Феруму(ІІІ); вміти складати рівняння хімічних реакцій, що ілюструють хімічні властивості заліза, якісне визначення сполук Феруму(ІІ) […]...
- Елементи головних і побічних підгруп – Періодична система елементів і хвильова модель БУДОВА АТОМА 6 . Хвильова модель 6.3 . Періодична система елементів І хвильова модель Порядок розташування елементів у періодичній системі можна пояснити на основі принципу заповнення орбіталей. Електронну конфігурацію будь-якого елемента можна вивести, виходячи із трьох принципів, що знаходяться в тісному зв’язку з урахуванням квантових чисел. – Рівні з меншою енергією заповнюються в першу чергу […]...
- Твердість води та способи її усунення – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.9. Твердість води та способи її усунення У природі чистої води не буває: вона завжди містить домішки яких-небудь речовин. Зокрема, взаємодіючи із солями, що містяться в земній корі, вона набуває певної твердості. Твердість води – сукупність […]...
- Солі натрію і калію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.4. Солі натрію і калію Натрій утворює солі з усіма кислотами. Майже всі його солі розчинні у воді. Найважливіші з них – хлорид натрію (кухонна сіль), сода і сульфат натрію. Хлорид натрію NaCl – необхідна приправа […]...
- Алюміній. Алюміній оксид і алюміній гідроксид, їх амфотерність – Метали Хімія Неорганічна хімія Метали Алюміній. Алюміній оксид і алюміній гідроксид, їх амфотерність Алюміній Алюміній Розташований в IIIА групі (III групі, головній підгрупі) Періодичної системи. Електронна конфігурація атома Алюмінію: На зовнішньому енергетичному рівні три електрони, ступінь окиснення в сполуках +3. Алюміній – найпоширеніший метал у земній корі. Зустрічається тільки у вигляді сполук (алюмосилікати, боксити, корунд, кріоліт). […]...
- Способи виробництва сталі – Метали Хімія Неорганічна хімія Метали Способи виробництва сталі Сталь – сплав заліза з вуглецем та іншими домішками. Масова частка Карбону в сталі не перевищує 1,7 %. У процесі переробки чавуну на сталь у сплаві зменшується вміст Карбону, Силіцію, Фосфору, Сульфуру, Мангану. Їх видалення грунтується на реакціях окиснення киснем або ферум(ІІ) оксидом у розплаві. Отже, виплавлення сталі […]...
- Корозія металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.4. Корозія Металів Корозія (від лат. corrosio – роз’їдання) – це самовільний процес руйнування металів при взаємодії з навколишнім середовищем. Розрізняють кілька видів корозії, з яких найважливішими є […]...
- Тема 17. Загальні відомості про метали Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ НЕОРГАНІЧНА ХІМІЯ Тема 17. Загальні відомості про метали Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Установіть послідовність зростання металічних властивостей елементів: A. Аргентум; Б. Стронцій; B. Йод; Г. Станум. 2. Позначте твердження, що характеризує більшість металів за звичайних умов: […]...
- Сплави – Метали Хімія Неорганічна хімія Метали Сплави Сплави – це суміші, що складаються з двох або більше металів, а також металів і неметалів. Хімічний зв’язок у сплавах – металічний. Тому вони мають усі властивості металів. Властивості сплавів відрізняються від властивостей вихідних металів. Сплави добувають, змішуючи розплавлені метали, які потім охолоджуються й тверднуть. Повністю однорідні сплави – тверді […]...
- Алюміній оксид – Алюміній ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.4. Алюміній Алюміній – елемент головної підгрупи III групи періодичної таблиці, заряд ядра – +13. Хімічний символ – Аl, відносна атомна маса – 27. Природний алюміній майже повністю складається з єдиного стабільного ізотопу 27Аl зі слідами […]...
- Натрій і Калій як представники лужних металів – Метали Хімія Неорганічна хімія Метали Натрій і Калій як представники лужних металів Лужні метали Розміщені в IА групі (у I групі головної підгрупи) Періодичної системи. На зовнішньому енергетичному рівні у лужних металів розміщений один неспарений електрон, який легко віддається окисникам. Ступінь окиснення лужних металів у сполуках дорівнює +1. Електронна конфігурація атома Натрію: Електронна конфігурація атома Калію: […]...
- Метали та сплави в техніці – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ § 12.4. Метали та сплави в техніці Сплавами називаються системи, що складаються з двох і більше металів, а також металів і неметалів. Властивості сплавів дуже різноманітні і відрізняються від властивостей вихідних компонентів. Так, наприклад, сплав, що складається […]...
- Корозія металів – Метали Хімія Неорганічна хімія Метали Корозія металів Корозія – руйнування металу під дією навколишнього середовища. Це окисно-відновний процес. Хімічна корозія – руйнування металу під час його окиснення без виникнення електричного струму в системі. При цьому метал взаємодіє з газами (газова корозія) і рідкими неелектролітами (бензин, нафта, толуол та ін.). Наприклад, сполука металів із киснем повітря. Електрохімічна […]...
- Фізичні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.2. Фізичні властивості металів Особливості металічного зв’язку і кристалічних граток зумовлюють загальні фізичні властивості різних металів. 1. Агрегатний стан металів твердий (крім ртуті й, умовно, францію1). Температура плавлення […]...
- Елементи-метали в Періодичній системі – Метали Хімія Неорганічна хімія Метали Елементи-метали в Періодичній системі Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп). Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів: – мале число електронів на зовнішньому енергетичному […]...
- Фізичні властивості металів – Метали Хімія Неорганічна хімія Метали Фізичні властивості металів Пластичність. Механічна дія на кристал із металічним зв’язком викликає зсув шарів атомів, але завдяки переміщенню валентних електронів по всьому зразку металу розриву зв’язків не відбувається. Найпластичніший метал – золото. Марганець і бісмут – крихкі метали. Металічний блиск, непрозорість. Вільні електрони взаємодіють із квантами світла, які падають на метал. […]...
- Загальні способи добування металів. Електроліз розплавів солей і лугів – Метали Хімія Неорганічна хімія Метали Загальні способи добування металів. Електроліз розплавів солей і лугів Металургія – це галузь промисловості, яка займається видобуванням металів із руд. Електроліз – окисно-відновний процес, що відбувається на електродах під час проходження електричного струму через розплав або розчин електроліту. Якщо в розплав електроліту, наприклад натрій хлориду, занурити інертні електроди й пропускати постійний […]...
- Метали в природі – Метали Хімія Неорганічна хімія Метали Метали в природі У природі метали існують переважно у вигляді сполук: оксидів, сульфідів, сульфатів, хлоридів, карбонатів і т. д. У вільному стані в земній корі зустрічаються найменш активні метали – золото, платина. Мідь, ртуть, срібло, олово можуть траплятися як у саморідному стані, так і в складі сполук. Мінерали й гірські породи, […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...
- ЛУЖНІ МЕТАЛИ – ПРОСТІ РЕЧОВИНИ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ ЛУЖНІ МЕТАЛИ – ПРОСТІ РЕЧОВИНИ Атоми лужних металів мають по одній валентній орбіталі, що містить один електрон, тому, мабуть, ці атоми можуть з’єднуватися між собою і утворювати двохатомні молекули. Формально електронна будова такої молекули не відрізняється: від будови молекули Н2 або двохатомних молекул галогенів. Таким чином, елементи ІА групи […]...