Хромати і дихромати – МЕТАЛИ ПОБІЧНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП
§ 14.4. Хромати і дихромати
Хромові кислоти утворюють два ряди солей: хромати – так називаються солі хроматної кислоти – і дихромати – так називаються солі дихроматної кислоти. Хромати мають жовте забарвлення (колір хромат-іона Сr2-4 ), дихромати – оранжеве (колір дихромат-іона Сr2)2-7).
Іони СrО2-4 і Сr2О2-7 взаємно перетворюються при зміні концентрації іонів гідрогену за рівнянням:
2Сr2O2-4 + 2Н+ ⇆
І
Сr2O2-7 + 2OН ⇆ 2СrO24- + Н2О.
Звідси видно, що якщо підкиснити розчин, то рівновага буде зміщуватися в бік утворення дихромат-іонів Сr2О2-7, і навпаки, якщо добавляти луги, то рівновага буде зміщуватися в бік утворення хромат-іонів СrО2-. Так хромати можна перетворити на дихромати і навпаки.
Дихромати Na2Cr2O7 ∙ 2Н2О і К2Сr2О7 називаються хромпіками. Вони як окисники застосовуються у шкіряній (дублення шкір), лакофарбовій, сірниковій та текстильній ‘промисловості. Хромову суміш – так називають 3 %-вий розчин дихромату калію у концентрованій сульфатній кислоті – застосовують у хімічних лабораторіях
Солі хроматних кислот у кислому середовищі – сильні окисники. Наприклад:
+4 +6 +6 +3
3SO2 + К2Сr2О7 + H2SO4 = K2SO4 + Cr2(SO4)3 + Н2О;
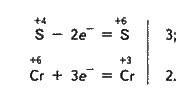
Сполуки хрому(ІІІ) у лужному середовищі відіграють роль відновників. Під дією різних окисників – Сl2, Вr2, Н2О2, КМnO4 тощо – вони переходять у сполуки хрому(ІV) – хромати:
+3 0 +6 -1
2Na + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O;
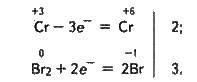
Тут сполука Сr(ІІІ) зображена у формі Na, оскільки у вигляді іонів Na і – вона міститься в надлишку розчину лугу.
Сильні окисники, такі, як KMnO4, (NH4)2S2O8, у кислому середовищі переводять сполуки Сr(ІІІ) у дихромати:
+3 +7 +6 +4
Cr2(SO4)3 + 2КМnO4 + 7Н2О = К2Сr2О7 + 2Мn(ОН)4 + 3H2SO4;
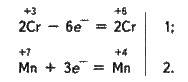
Отже, окисні властивості послідовно зростають зі зміною
+2 +3 +6
Ступенів окиснення в ряду: Сr -> Сr -> Сr. Сполуки Сr(ІІ) – сильні відновники, легко окиснюються, перетворюючись на сполуки хрому(ІІІ). Сполуки хрому(VІ) – сильні окисники, легко відновлюються до сполук хрому(ІІІ). Сполуки з проміжним ступенем окиснення, тобто сполуки хрому(ІІІ), можуть при взаємодії з сильними відновниками виявляти окисні властивості, переходячи у сполуки хрому(ІІ), а при взаємодії з сильними окисниками (наприклад, бромом, КМnO4) виявляти відновні властивості, перетворюючись на сполуки xpoMy(VI).
Солі хрому(ІІІ) дуже різноманітні за забарвленням: фіолетові, сині, зелені, коричневі, оранжеві, червоні та чорні. Усі хроматні кислоти та їх солі, а також оксид хрому(VІ) отруйні: уражають шкіру, дихальні шляхи, викликають запалення очей, тому, працюючи з ними, необхідно дотримувати усіх запобіжних заходів.