Загальна характеристика підгрупи галогенів – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ
§ 8.5. Загальна характеристика підгрупи галогенів
Під час розгляду хімії елементів за підгрупами винятково важливо вміти використовувати прогнозуючу роль періодичного закону і періодичної системи елементів Д. І. Менделєєва. Тоді багато властивостей елементів і їх сполук можна описати, не користуючись підручниками. Так, за положенням елемента в періодичній системі можна описати будову атома – заряд і склад
– визначити ступені окиснення елемента у сполуках, можливість утворення молекули за звичайних умов, тип кристалічної решітки простої речовини у твердому стані. Нарешті, можна визначити формули вищих оксидів і гідроксидів елементів, зміну їх кислотно-основних властивостей по горизонталі і вертикалі періодичної системи, а також формули різних бінарних сполук з оцінкою характеру хімічних зв’язків. Це значно полегшує вивчення властивостей елементів, простих речовин і їх сполук. Розпочинати слід із розгляду загальної характеристики кожної підгрупи.
До
Вони легко приєднують по одному електрону, виявляючи ступінь окиснення – 1. Такий ступінь окиснення галогени виявляють у сполуках з гідрогеном і металами.
Таблиця 8.1. Властивості елементів підгрупи галогенів
Властивість | F | Сl | Вr | L | At |
1. Порядковий номер | 9 | 17 | 35 | 53 | 85 |
2. Валентні електрони | 2s22p5 | 3 s2 3р5 | 4s24p5 | 5s25 р5 | 6s26p5 |
3. Енергія іонізації атома, еВ | 17,42 | 12,97 | 11,84 | 10,45 | 9,20 |
4. Відносна електронегативність | 4,1 | 2,83 | 2,74 | 2,21 | 1,90 |
5. Ступінь окиснення в сполуках | – 1 | -1,+ 1, +3,+5, +7 | -1.+ 1, +3,4-5, +7 | -1.+ 1, +3,+5, +7 | -1.+ 1, +3,+5, +7 |
6. Радіус атома, нм | 0,0064 | 0,099 | 0,114 | 0,133 | – |
Однак атоми галогенів, крім флуору, можуть виявляти і позитивні ступені окиснення: +1, +3, +5, +7. Можливі значення ступенів окиснення пояснюються електронною будовою атомів, яку в атома флуору можна зобразити схемою:
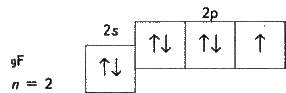
Як найбільш електронегативний елемент, флуор може приєднати тільки один електрон на 2р-підрівень. У нього один неспарений електрон, тому флуор буває тільки одновалентним, а його ступінь окиснення завжди -1.
Електронна будова атома хлору зображується схемою:
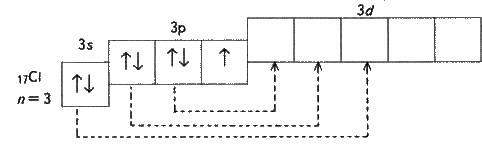
В атома хлору один неспарений електрон на 3р-підрівні, і в звичайному (незбудженому) стані хлор одновалентний. Але оскільки хлор розташований в третьому періоді, то в нього є ще п’ять орбіталей 3d – підрівня, на яких можуть розташуватися 10 електронів.
У збудженому стані атома хлору електрони переходять з 3р – і Зs-підрівнів на 3d – підрівень (на схемі зображено стрілками). Роз’єднання (розпаровування) електронів, що перебувають на одній орбіталі, збільшує валентність на дві одиниці. Очевидно, хлор і його аналоги (крім флуору) можуть виявляти лише непарну змінну валентність 1, 3, 5, 7 і відповідні позитивні ступені окиснення. У флуору немає вільних орбіталей, а отже, під час хімічних реакцій не відбувається роз’єднання спарених електронів в атомі (див. електронну будову атома флуору). Тому, розглядаючи властивості галогенів, завжди слід враховувати особливості флуору і його сполук.
Водні розчини водневих сполук галогенів є кислотами: HF – фтороводнева, або фторидна плавикова), НСl – хлороводнева (соляна), або хлоридна, НВr – бромоводнева, або бромідна, Нl – йодоводнева, або йодидна.
Слід мати на увазі, що крім спільних властивостей галогени мають і відмінності. Це особливо характерно для флуору і його сполук. Сила кислот у ряду зростає, що пояснюється зменшенням у цьому самому напрямку енергії зв’язку HR (де R – елемент). Плавикова кислота найслабкіша у цьому ряду, оскільки енергія зв’язку Н – F тут найбільша. В такій самій послідовності зменшується і міцність молекули НГ (де Г – галоген), що зумовлено збільшенням між’ядерної відстані (див. табл. 8.1, п. 6). Розчинність малорозчинних солей зменшується в ряду АgСl – АgВr – Аgl; на відміну від них сіль AgF добре розчиняється у воді.
Флуор найміцніше утримує електрони (див. табл. 8.1, п. З, 4), у нього один ступінь окиснення (-1) (див. табл. 8.1, п. 5). Фтор інакше взаємодіє з водою, ніж хлор: розкладає воду з утворенням фтороводню, фториду оксигену(ІІ), пероксиду гідрогену, кисню й озону:
F2 + Н2О = 2HF + О; 2O = О2; 3О = О3;
O + F2 = F2O; Н2O + О = Н2О2.
Рівняння реакції взаємодії хлору з водою див. § 8.6.
Пункти 3 і 6 табл. 8.1 характеризують неметалічні властивості елементів. Оскільки радіус атома зростає, а енергія іонізації зменшується, то в ряду F – At послаблюються неметалічні властивості. Найсильніше вони виражені у флуору.
Реакційна здатність галогенів послаблюється в ряду F – Сl – Вr – l. Тому попередній елемент здатний витісняти наступний з кислот типу НГ (Г – галоген) і їх солей. В цьому випадку активність
F2 > Сl2 > Вr2 > l2.
Закономірно змінюються фізичні властивості галогенів із зростанням порядкового номера: фтор – газ, що важко зріджується, хлор – газ, що легко зріджується, бром – рідина, йод – тверда речовина.