Електронна природа хімічного зв’язку. Поняття про електронегативність
Тема 4
ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ
УРОК 55
Тема. Електронна природа хімічного зв’язку. Поняття про електронегативність
Цілі уроку: ознайомити учнів із причинами виникнення хімічного зв’язку між атомами в процесі утворення простих і складних речовин, типами хімічного зв’язку; розкрити зміст поняття електронегативність та його застосування для визначення типу хімічного зв’язку; поглибити знання про періодичний закон і будову атома на прикладі утворення хімічного зв’язку між атомами різних хімічних
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь учителя, фронтальна евристична бесіда.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця електронегативностей, схеми будови атомів елементів I-III періодів.
ХІД УРОКУ
І. Організація класу
Вступне слово вчителя (загальні уявлення про місце досліджуваної теми в курсі хімії в школі, оголошення теми, плану й основних цілей теми)
II. Актуалізація опорних знань, мотивація навчальної діяльності
Фронтальна бесіда (робота з періодичною системою хімічних елементів і схемами будови атомів хімічних елементів)
1.
2. Наведіть приклади хімічних елементів з незавершеним зовнішнім енергетичним рівнем.
3. За якими властивостями відрізняються елементи із завершеним і незавершеним зовнішнім енергетичним рівнем?
4. Наведіть приклади елементів-металів.
5. Наведіть приклади елементів-неметалів.
6. Чим відрізняється будова зовнішнього енергетичного рівня в елементів металів і неметалів?
7. Наведіть приклади s-елементів, p-елементів, d-елементів, f-елементів.
Розповідь учителя
У природі рідко коли можна зустріти атоми у вільному стані. Найчастіше вони утворюють велику кількість сполук з іншими атомами. Причина стійкості молекул полягає в тому, що між сполученими атомами в молекулі виникає хімічний зв’язок, в утворенні якого головну роль відіграють електрони зовнішнього рівня.
III. Вивчення нового матеріалу
Основна причина утворення зв’язку між атомами – їх прагнення утворити стійку електронну конфігурацію зовнішнього енергетичного рівня. Таким рівнем можна вважати восьми-електронний завершений рівень ns2np6, наприклад у інертних елементів. Завершений рівень характеризується високою міцністю і стійкістю. У процесі хімічної взаємодії атоми прагнуть перетворити зовнішній енергетичний рівень так, щоб він став завершеним.
У процесі утворення хімічного зв’язку атоми перебудовують зовнішній енергетичний рівень. При цьому атоми можуть віддавати або приєднувати (частково чи повністю) електрони зовнішнього енергетичного рівня. Учення про будову атомів пояснює механізм утворення молекул простих і складних речовин, а також природу хімічного зв’язку. Кількісно здатність притягувати електрони зовнішнього енергетичного рівня інших атомів вимірюється поняттям електронегативності.
– Який елемент має найбільшу електронегативність?
– Який елемент має найменшу електронегативність?
– В яких елементів – металів чи неметалів – електронегативність менша?
З допомогою таблиці електронегативностей розглянемо можливі схеми перетворення зовнішнього енергетичного рівня в металів і неметалів.
IV. Закріплення нового матеріалу
Побудуємо електронну формулу Натрію. Це метал, може лише віддавати електрони.
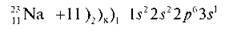
Охарактеризуємо зовнішній рівень атома Натрію: незавершений, один неспарений електрон. Атом Натрію легко може віддати один електрон, при цьому змінюється електронна формула:
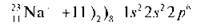
Зовнішній енергетичний рівень перетворюється на завершений (як в атома Неону, але атом стає зарядженою частинкою – позитивним іоном).
Аналогічно розглядаємо схеми будови атома Магнію та іона Магнію.
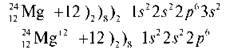
У іона Магнію зовнішній рівень завершений, як в атома Неону. Розглянемо атом Флуору. Це найсильніший неметал, має найвищу електронегативність, може лише приєднувати електрони.
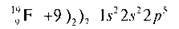
Незавершений сьомий електронний зовнішній рівень Флуору перетворюється на завершений, як в атома Неону.
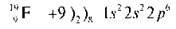
Пропонуємо учням самостійно записати будову атома й електронні формули атома та іона Оксигену.
V. Підбиття підсумків уроку
– У чому причина утворення хімічного зв’язку між атомами?
– Чому атоми різних елементів утримуються один біля одного?
– Чому можливе утворення хімічного зв’язку і між атомами однакових, і між атомами різних хімічних елементів?
VI. Домашнє завдання
Опрацювати відповідний параграф підручника і відповісти на запитання.
