Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості
Тема 3
НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ
Урок 35
Тема уроку. Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості
Цілі уроку: формувати знання учнів про гомологічні ряди алкенів і алкінів на прикладі етилену й ацетилену; ознайомити учнів із природою кратного зв’язку, новими видами ізомерії – ізомерією положення кратного зв’язку, міжкласовою ізомерією; удосконалювати навички й уміння складати структурні формули й давати назви органічним сполукам на прикладі алкенів і алкінів; ознайомити з фізичними
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна робота, лабораторна робота.
Обладнання: схеми будови етилену й ацетилену, куле-стрижневі моделі етилену й ацетилену, фрагмент медіа-фільму “sp2- і sp-гібридизація електронів у атомі Карбону”.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
1. Перевірка домашнього завдання біля дошки – формули ізомерів гексану та їх назви
2. Фронтальна
1) Сформулюйте основні положення теорії хімічної будови.
2) Що таке гібридизація? Що відбувається з електронними орбіталями атома Карбону в процесі sp3-гібридизації?
3) Як утворюється о-зв’язок? Яка його міцність?
4) Як взаємозалежні властивості алканів з будовою їхніх молекул?
III. Вивчення нового матеріалу
1. Загальна характеристика ненасичених вуглеводнів
(Упродовж уроку заповнюється порівняльна схема.)
Характеристика | Алкани | Алкени | Алкіни |
Загальна формула | CnH2n+2 | CnH2n | CnH2n-2 |
Гомологічний ряд | CH4, C2H6, C3H8, C4H10… | C2H4, C3H6, C4H8… | C2H2, C3H4, C4H6… |
– Чому гомологічні ряди алкенів і алкінів починаються з вуглеводнів, що містять два атоми Карбону, а не один, як в алканів?
(За загальною формулою виходять формули речовин CH2 і CH0, що не відповідає валентності Карбону)
Лабораторний дослід 6 “Складання моделей молекул вуглеводнів”
1. Складіть моделі молекул етану, етилену й ацетилену.
2. Зробіть висновок про відмінності в будові й міцності зв’язків у цих молекулах.
Пропонуємо учням фрагмент медіафільму про гібридизацію електронів і зв’язки в молекулах етану, етену й етину.
Вид гібридизації атома Карбону | Sp2-гібридизація: відбувається змішування однієї s – і двох р-орбіталей, а одна р-орбіталь залишається не гібридизованою | Sp2-гібридизація: відбувається змішування однієї s – і двох р-орбіталей, а одна р-орбіталь залишається не гібридизованою
| Sp-гібридизація: відбувається змішування однієї s – і однієї р-орбіталі, а дві р-орбіталі залишаються не гібридизованими
|
Види зв’язків | C – H?-зв’язок C – C?-зв’язок | C – H?-зв’язок C = C? – і п-зв’язки | C – H?-зв’язок C = C? – і 2п-зв’язки |
Довжина зв’язку | 0,154 нм | 0,133 нм | 0,120 нм |
Кут зв’язку | 109° 28′ | 120° | 180° |
Енергія зв’язку | 374,4 кДж/моль | 611,1 кДж/моль | 834,3 кДж/моль |
?-зв’язок – це ковалентний зв’язок, що виникає внаслідок перекривання орбіталей по обидва боки від лінії, що з’єднує центри атомів, які зв’язуються.
П-зв’язок менш міцний, ніж?-зв’язок.
Розгляньмо моделі молекул етену й етину.
Чому рухливість атомів Карбону навколо кратного зв’язку обмежена?

Вид ізомерії | 1. Ізомерія карбонового скелета |
2. Ізомерія положення C = C і C | |
Номенклатура | 1. У головному ланцюзі обов’язково має бути кратний зв’язок |
2. Нумерація головного ланцюга починається з того кінця, до якого ближче кратний зв’язок | |
3. Положення кратного зв’язку вказується після назви вуглеводню | |
Суфікс у назві головного ланцюга для алкенів – – ен(-єн). Суфікс у назві головного ланцюга для алкінів – – ин(-ін) |
Однією з причин різноманіття органічних сполук є міжкласова ізомерія – явище існування ізомерів з різних класів органічних сполук. Наприклад, для алкенів міжкласовими ізомерами будуть циклоалкани: бутен – циклобутан. Зобразіть структурні формули цих сполук – і переконаєтеся в правильності твердження про ізомерію цих сполук.
Для алкінів міжкласовими ізомерами будуть, наприклад, органічні сполуки, що містять два подвійні зв’язки. Запропонуйте структурні формули таких ізомерів для бутину й бутадієну.
2. Фізичні й хімічні властивості алкенів і алкінів
(Заповнюється порівняльна таблиця під керівництвом учителя)
Характеристика | Алкани | Алкени | Алкіни |
Фізичні властивості | C2H6 – етан. Газ, без запаху, Tпл = -182,8 °С, tкип = -88,6 °С, Незначною мірою розчиняється у воді, краще – в органічних розчинниках | C2H4 – етилен. Газ, зі слабким запахом, Tпл = -169,5 °С, tкип = -103,8 °С, Незначною мірою розчиняється у воді, краще – в органічних розчинниках | C2H2 – ацетилен. Газ, без запаху, Tпл = -80,8 °С (за 170 кПа), tкип = -83,8 °С (возгонка), слабко розчинний у воді, добре – в ацетоні під тиском |
У разі збільшення кількості атомів Карбону в молекулі вуглеводню його температури кипіння й плавлення підвищуються.
IV. Первинне застосування одержаних знань
Тренувальні вправи
1. Напишіть структурні формули речовин (по ланцюжку біля дошки):
А) етен;
Б) етин;
В) пропен;
Г) пропін;
Д) 2-метил-1-бутен;
Е) 3-метил-1-бутин.
2. Самостійна робота під керівництвом учителя з наступною усною перевіркою
– Дайте назви речовинам за структурними формулами:
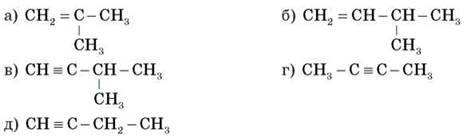
– Складіть формули двох гомологів для речовин:
А) CH 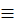 CH
CH
Б) CH2 = CH – CH2 – CH3
– Складіть формули ізомерів, дайте їм назви:
А) C4H8;
Б) C5H8.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання
1) Підготувати повідомлення про застосування етену й етину.
2) З допомогою довідкової літератури скласти термохімічні рівняння горіння етену й етину.