Їдкі луги – МЕТАЛИ ГОЛОВНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП
§ 13.3. Їдкі луги
Їдкими лугами називаються добре розчинні у воді гідроксиди. Найважливіші з них NaOH та КОН.
Гідроксид натрію і гідроксид калію – білі, непрозорі, тверді кристалічні речовини. У воді добре розчиняються з виділенням великої кількості теплоти. У водних розчинах практично повністю дисоціюють і є сильними лугами. Виявляють усі властивості основ.
Тверді гідроксиди натрію і калію та їх
NaOH + СO2 = NaHCO3;
2NaOH + CO2 = Na2CO3 + H2O
Або в іонній формі:
ОН – + СО2 = HCO-3
2OН – + СO2 = СO2-3 + Н2О.
У твердому стані на повітрі NaOH і КОН поглинають вологу, завдяки чому використовуються як осушувачі газів.
У промисловості гідроксид натрію і гідроксид калію добувають електролізом концентрованих розчинів відповідно NaCl і КСl. При цьому одночасно утворюються хлор і водень. Катодом є залізна сітка, анодом – графіт.
Схему електролізу (на прикладі КСl) слід уявляти так. КСl повністю дисоціює на іони К+ і Сl – . При проходженні електричного струму до катода підходять
2Н2O + 2е – = Н2 + 2OН-.
Хлорид-іони в концентрованому розчині легше віддають електрони (окиснюються), ніж молекули води, тому на аноді розряджаються хлорид-іони:
2Сl – – 2е – = Сl2.
Загальне рівняння електролізу розчину в іонній формі:
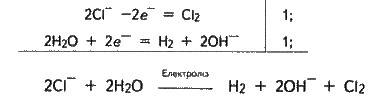
Або
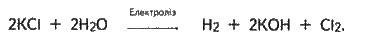
Аналогічно відбувається електроліз розчину NaCl (див. § 7.7). Розчин, який містить NaOH і NaCl, випаровують, внаслідок чого випадає в осад хлорид натрію (він має набагато меншу розчинність і вона мало змінюється з температурою), який відокремлюють і використовують для подальшого електролізу.
Гідроксид натрію добувають у дуже великих кількостях. Він є одним з важливих продуктів основної хімічної промисловості. Застосовують його для очистки продуктів нафти – бензину і гасу, для виробництва мила, штучного шовку, паперу, в текстильній, шкіряній, хімічній промисловості, а також у побуті (каустик, каустична сода).
Дорожчий продукт – гідроксид калію – застосовується рідше, ніж NaOH.