Алюміній – МЕТАЛИ ГОЛОВНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП
§ 13.11. Алюміній
Природні сполуки алюмінію. Алюміній належить до найпоширеніших елементів. Серед металів за поширенням у природі він посідає перше місце. Загальний вміст алюмінію в земній корі становить 8,8 %. Найважливіші природні сполуки алюмінію – алюмосилікати, боксит, корунд та кріоліт.
Алюмосилікати становлять основну масу земної кори, їх можна розглядати як солі, утворені оксидами алюмінію,
Боксити – гірська порода, що складається переважно з гідратованого оксиду алюмінію та оксидів феруму, які надають їм червоного кольору. Містять від 30 до 60 % Аl2О3. З бокситів добувають алюміній. Родовища бокситів розташовані на Уралі, в Ленінградській області, Башкирії,
Корунд – мінерал складу Аl2О3, має високу твердість, застосовується як абразивний матеріал.
Кріоліт – мінерал складу AlF3 ∙ 3NaF, або Na3AlF6. Нині його добувають штучно, застосовують у металургії алюмінію.
Добування алюмінію. У промисловості алюміній добувають електролізом розчину оксиду алюмінію в розплавле ному кріоліті Na3AlF6 з добавкою фториду кальцію CaF2. Електроліз здійснюють при 950-980°С. Сировину використовують чисту, оскільки домішки при електролізі відновлюються і забруднюють алюміній.
Чистий оксид алюмінію Аl2О3, вільний від води, оксидів феруму, а також від оксиду силіцію(ІV), добувають з бокситу і останнім часом – з нефеліну. Він добре розчиняється у розплавленому кріоліті. Добавка фториду кальцію сприяє підтриманню температури близько 1 000°С, підвищує електричну провідність електроліту, зменшує його густину, що сприяє виділенню алюмінію на дні ванни. Під час електролізу такого розплаву алюміній виділяється на катоді:
2Аl3+ + 6е – = 2Аl.
На вугільному аноді розряджаються оксид-іони О, що входять до складу Аl2О3:
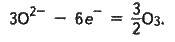
Електролізер являє собою стальну ванну прямокутної форми (рис. 13.1), викладену зсередини вогнетривкою цеглою і блоками з вугільної маси. У блоки на дні ванни закладено стальні стержні, кінці яких виведено назовні. Ці блоки разом з розплавленим алюмінієм є катодом. Анод складається з 12-14 вугільних брусків і зверху опущений у ванну. Кисень, що виділяється, окиснює вугільний анод до СО і СО2. Матеріал анода при цьому витрачається, тому анод в міру окиснення поступово опускається.
Згори і біля бічних стінок ванни електроліт охолоджується навколишнім повітрям і застигає суцільною кіркою. У ній біля
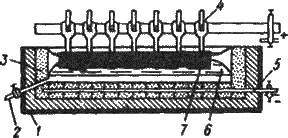
Рис. 13.1. Схема електролітичного добування алюмінію:
1 – стальна ванна;2 – канал для стікання розплавленого алюмінію; З – термічна ізоляція з вогнетривкої цегли;- анод з вугільних брусків;
5 – катод з вугільних брусків і розплавленого алюмінію;
6 – оксид алюмінію в розплавленому кріоліті;- кірка
Анодів пробивають отвори для виходу газів, які утворюються під час окиснення анода. При завантаженні ванни спочатку вводять кріоліт і фторид кальцію. Після їх розплавляння (пропусканням електричного струму) додають чистий оксид алюмінію або очищений боксит.
Виробництво алюмінію потребує значних витрат електроенергії і матеріалів: для добування 1 т алюмінію витрачається близько 20 тис. кВт год електроенергії, близько 2 т оксиду алюмінію, 40-60 кг кріоліту, 20-30 кг добавок інших фторидів і 20-30 кг анодного вугілля. Тому заводи з виробництва алюмінію звичайно будують біля великих гідроелектростанцій, які виробляють дешеву електроенергію (Волховська, Братська, Красноярська та ін.).
Фізичні властивості. Алюміній – сріблясто-білий метал, легкий, але механічно міцний. Густина його дорівнює 2,7 г/см3, т. пл. 660°С. Має високу електричну провідність, але поступається у цьому перед міддю. Легко піддається обробці: прокатується у фольгу, витягується в тонкий дріт, відливається. Легко утворює сплави. При 600°С алюміній стає крихким, і його можна подрібнити на зернини або порошок. Природний алюміній складається з одного ізотопу 2713Аl(100 %).
Хімічні властивості. В атома алюмінію на зовнішньому енергетичному рівні розташовані три електрони, які він віддає при хімічній взаємодії. У всіх своїх стійких сполуках алюміній має ступінь окиснення +3. Він є сильним відновником.
Алюміній легко сполучається з киснем уже при звичайній температурі. При цьому його поверхня вкривається оксидною плівкою Аl2О3, яка захищає метал від подальшого окиснення. Товщина оксидної плівки становить 0,00001 мм. Вона міцна, тверда і гнучка, не відстає при розтягуванні, стискуванні, закручуванні та згинанні, проводить струм, плавиться при 2050°С, в той час як алюміній – при 660°С. Оксидна плівка надає поверхні матового вигляду. Завдяки їй алюміній не руйнується (не кородує) від вологи й повітря.
Якщо оксидну плівку зруйнувати (наприклад, потерти поверхню алюмінію наждачним порошком або опустити його ненадовго в гарячий розчин лугу), то алюміній взаємодіятиме з водою:
2Аl + 6Н2О = 2Аl(ОН)3 + ЗН2↑.
При звичайній температурі алюміній практично не взаємодіє з концентрованою і дуже розведеною нітратною кис лотою1 (внаслідок утворення захисної оксидної плівки), тому HNO3 зберігають і перевозять в алюмінієвій тарі. Проте він розчиняється в хлоридній і сульфатній кислотах:
2Аl + 6Н+ = 2Аl3+ + 3Н2↑.
На відміну від багатьох металів на алюміній дуже сильно діють розчини лугів. Наприклад:
2Аl + 2NaOH + 10Н2О = 2Na + ЗН2↑
Або в іонній формі:
2Аl + 2OН – + 10Н2О = 2 – + ЗН2↑.
Тому в алюмінієвому посуді не можна зберігати луги та лужні розчини.
За пропозицією хіміка О. І. Горбова, під час російсько – японської війни взаємодією алюмінію з лугом добували водень для аеростатів, що було пов’язано з легкістю перевезення вихідних речовин.
При нагріванні алюміній реагує з галогенами, а при високій температурі – із сіркою, азотом і вугіллям:
2Аl + ЗСl2 = 2АlСlЗ; 2А + N2 = 2AlN;
2Аl +3S = Al2S3; 4Аl + ЗС = А/span>l4С3.
1 Дуже повільно алюміній розчиняється в нітратній кислоті середніх концентрацій.