Бензен як представник ароматичних вуглеводнів
Тема 3
НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ
Урок 41 (за рахунок резервного часу)
Тема уроку. Бензен як представник ароматичних вуглеводнів
Цілі уроку: ознайомити учнів з бензеном як представником нового гомологічного ряду – аренів, особливостями утворення нового виду зв’язку – ароматичного, з використанням бензену та його похідних, з поняттям “хімічні засоби захисту рослин”, їх впливом на екологічний стан біоценозів.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми
Обладнання: схеми “Використання бензену та його похідних”, “Будова молекули бензену”, медіафільм про будову бензену.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання. Актуалізація опорних знань. Мотивація навчальної діяльності
Фронтальна робота
– Опишіть, чим відрізняються sp3, sp2, sp-гібридизації.
– Дайте визначення: ковалентний зв’язок, ?-зв’язок, п-зв’язок.
III. Вивчення нового матеріалу
Бензен як представник ароматичних вуглеводнів
Розповідь учителя
Під час вивчення конденсованих
Молекулярна формула бензену – C6H6.
Бензен мав своєрідний запах і проявляв дивні хімічні властивості. Незважаючи на свою “ненасиченість”, бензен важко вступав у реакції приєднання, але легко давав реакції заміщення атомів Гідрогену. Тому бензен та його похідні виділили в спеціальний клас, якому дали назву “ароматичні вуглеводні”, або “арени”.
Першим структурну формулу бензену запропонував у 1865 році німецький хімік А. Кекулє:
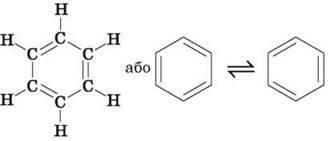
Сучасні дослідження будови молекули бензену показали, що молекула являє собою правильний плаский шестикутник. Усі зв’язки C – C однакові, а їх довжина не відповідає ні ординарному, ні подвійному зв’язку. Кути між зв’язками дорівнюють 120°.
Атоми Карбону в молекулі бензену знаходяться у стані sp2-гібридизації, кожен атом утворює три о-зв’язки й надає одну р-орбіталь для утворення сполученої системи із шести п-електронів.
(Розглядаємо схему будови молекули бензену.)
Тому структурну формулу бензену зображують так:
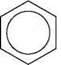
Фізичні властивості бензену
Рідина, без кольору, із запахом, tпл = 5,5 °С, tкип = 80 °С, не розчиняється у воді, сам є чудовим неполярним розчинником.
Хімічні властивості бензену
А) Горіння:
C6H6 + 7,5O2  6CO2 + 3H2O + Q (кіптяве полум’я)
6CO2 + 3H2O + Q (кіптяве полум’я)
Б) Заміщення атомів Гідрогену в бензольному кільці (протікає легше, ніж в алканів):
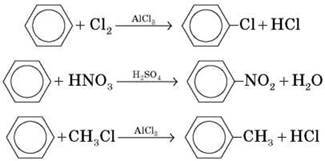
В) Приєднання (протікає складніше, ніж в алкенів):
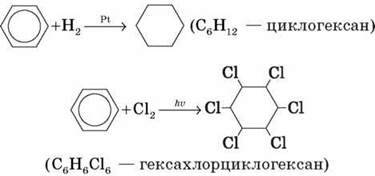
Застосування бензену та його гомологів (Розглядаємо й обговорюємо схему на дошці.)
– Отрутохімікати
– Розчинники
– Вибухові речовини
– Добавки до пального
– Органічний синтез, наприклад, одержання аніліну, фенолу, стиролу й полістиролу, лікарських препаратів
IV. Підбиття підсумків уроку
Хімічні засоби захисту рослин, їх застосування, екологічні аспекти їх використання.
Оцінювання роботи учнів на уроці.
V. Домашнє завдання
Повторити матеріал про вуглеводні, їх властивості, способи одержання, сфери використання.