Електроліти та електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ
Електроліти та електролітична дисоціація
Усі речовини можна розділити на електроліти та неелектроліти. Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Розчини й розплави неелектролітів електричний струм не проводять.
До електролітів відносять речовини з іонною будовою, а також речовини з полярним ковалентним зв’язком: більшість солей, кислот, основ та деякі оксиди. До неелектролітів
Відомо, що переносниками електричного струму можуть бути заряджені частинки – електрони або іони. Електронна провідність властива речовинам з металічним зв’язком (металам та деяким бінарним сполукам). Такі провідники називають провідниками першого роду. Іонна провідність властива багатьом хімічним сполукам з іонною будовою, наприклад, розплавам багатьох солей, а також водним і неводним розчинам електролітів. Провідники, в яких носіями заряду є іони, називають провідниками другого роду. Для того щоб пояснити іонну провідність
Механізм електролітичної дисоціації
Насамперед треба відзначити принципову різницю причин іонної провідності й, відповідно, електролітичної дисоціації, сполуки з іонним та ковалентним полярним зв’язками.
В іонних сполуках (зокрема й натрій хлориді) існують уже “готові” іони, які розташовуються у вузлах кристалічної гратки. При підвищенні температури іонних сполук рухливість іонів прискорюється й при досягненні точки плавлення іони залишають свої місця й отримують можливість вільно пересуватися. При розчиненні відбувається процес гідратації іонів у кристалічній гратці й подальшого розпаду кристала під дією розчинника на гідратовані іони.
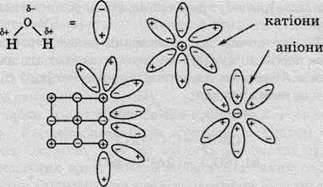
Таким чином, електролітична дисоціація іонних сполук є фактично процесом руйнування кристалічної гратки, який можна описати таким рівнянням:
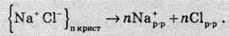
Утім, для спрощення електролітичну дисоціацію описують так:
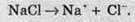
Процес електролітичної дисоціації сполук з ковалентним полярним зв’язком відбувається трохи інакше, головним чином за рахунок того, що в таких сполуках, незважаючи на те, що окремі атоми мають заряд, повноцінні іони ще не сформовані. Процес дисоціації сполук з ковалентним полярним зв’язком можна пояснити на прикладі хлороводню.
При потраплянні молекули хлороводню у воду, як і належить, відбувається її гідратація. Причому за рахунок заряду атомів Хлору й Гідрогену молекули води орієнтуються навколо молекули хлороводню у певний спосіб:
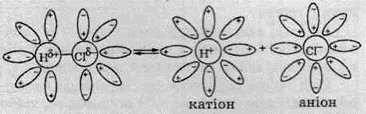
Молекули води за рахунок взаємодії з атомами Хлору та Гідрогену додатково поляризують зв’язок, що існує між ними. При цьому спільна електронна пара між атомами Гідрогену й Хлору додатково зміщується в бік хлору й ковалентний полярний зв’язок перетворюється в іонний. Унаслідок цього молекула хлороводню під дією молекул води розпадається на катіон Гідрогену та аніон Хлору. У вигляді рівняння процес дисоціації хлороводню можна записати так:
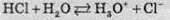
Або спрощено:
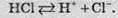
Сполуки з ковалентними неполярними або малополярними зв’язками під дією молекул розчинника не іонізуються, і тому їхні розчини не проводять електричний струм і вони не є електролітами.
Отже, електролітична дисоціація – це процес розпаду молекул на іони (позитивно заряджені катіони й негативно заряджені аніони) при розчиненні за рахунок додаткової поляризації ковалентного полярного зв’язку під дією молекул розчинника.
На підставі цього можна припустити, яким чином дисоціюють молекули різних електролітів.
Дисоціація кислот
За структурною формулою сульфатної кислоти можна визначити, що найбільш полярним зв’язком є зв’язок між атомами Гідрогену й Оксигену.
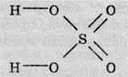
Таким чином, у розчині буде розриватися саме цей зв’язок. Зв’язок між Сульфуром та Оксигеном є слабкополярний (різниця електронегативностей дуже мала), отже, при дисоціації розриватися він не буде.
При дисоціації кислот утворюються катіони Гідрогену й аніони кислотних залишків. Рівняння електролітичної дисоціації кислот має такий вигляд:
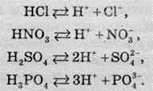
Таким чином, з погляду теорії електролітичної дисоціації Арреніуса, кислотами називають сполуки, під час дисоціації яких утворюються іони Гідрогену.
Загальні властивості розчинів кислот обумовлені саме катіонами н+, а концентрація цих іонів є кількісною мірою кислотності середовища.
Слід також зазначити, що дисоціація багато-основних кислот відбувається ступінчасто, тобто іони Гідрогену відщеплюються від молекул багато-основних кислот по одному:
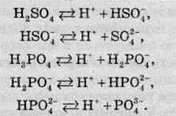
При ступінчастій дисоціації сульфатна кислота утворює різні аніони: HSO4- – гідроген сульфат-іон із зарядом -1 та SО42- – сульфат-іон із зарядом -2, а фосфатна кислота три аніони: Н2РО4- – дигідроортофосфат-іон, HPO42- – гідроортофосфат-іон, РО43- – фосфат-іон. Завдяки цьому багато-основні кислоти можуть утворювати не тільки середні, але й кислі солі:
NaHSО4 – натрій гідрогенсульфат,
Са(НСО3)2 – кальцій гідрогенкарбонат,
КН2РО4 – калій дигідрогенфосфат,
ВаНРО4 – барій гідрогенфосфат.
Дисоціація основ
За структурною формулою кальцій гідроксиду можна визначити, що максимальну полярність має зв’язок між атомами Кальцію й Оксигену.
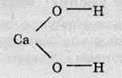
Таким чином, у розчині буде розриватися саме цей зв’язок. Зв’язок між Гідрогеном та Оксигеном є менш полярним (різниця електронегативностей менша), отже, при дисоціації він розриватися не буде.
При дисоціації основ утворюються катіони металів і гідроксид-аніони. Рівняння електролітичної дисоціації основ має такий вигляд:
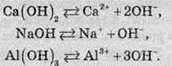
Згідно з теорією електролітичної дисоціації Арреніуса, основами називають сполуки, при дисоціації яких утворюються гідроксид-іони.
Загальні властивості розчинів основ обумовлені наявністю гідроксид-іонів он-, а концентрація цих іонів є кількісною мірою основності середовища.
Дисоціація багато-кислотних основ (окрім гідроксидів Барію, Стронцію й Кальцію) також відбувається ступінчасто, тобто гідроксид-іони відщеплюються по одному:
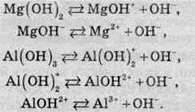
Завдяки явищу ступінчастої дисоціації гідроксидів можливе існування основних солей:
(СuОН)2СO3 – основний купрум(II) карбонат,
Аl(ОН)2Сl – дигідроксоалюміній хлорид.
Дисоціація солей
За структурною формулою натрій сульфату можна визначити, що найбільш полярним (з найбільшою різницею електронегативностей атомів) є зв’язок між атомами Натрію та Оксигену.
Таким чином, у розчині буде розриватися саме цей зв’язок. Зв’язок між Сульфуром та Оксигеном є слабкополярний (різниця електронегативностей дуже мала), отже, при дисоціації він розриватися не буде.
Таким чином, при дисоціації солей утворюються катіони металів та аніони кислотних залишків. Рівняння електролітичної дисоціації солей має такий вигляд:
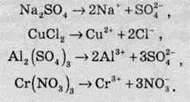
Розчини середніх солей не містять однакових іонів, тому не проявляють спільних властивостей, як розчини кислот або основ.
Окрім середніх солей, дисоціація яких описана вище, ще існують кислі та основні солі. При дисоціації кислих солей у розчинах також з’являються іони Гідрогену, а при дисоціації основних солей – гідроксид-іони. Наприклад,
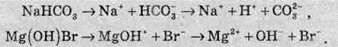
З погляду сучасних уявлень про теорії кислот і основ, у теорію Арреніуса не вписуються багато речовин, які є кислотами або основами, зокрема й такі речовини, як амоніак NH3 або анілін С6H5NH2.