Ферум. Залізо. Фізичні та хімічні властивості заліза: взаємодія з киснем, сіркою
Тема 2
ПРОСТІ РЕЧОВИНИ МЕТАЛИ Й НЕМЕТАЛИ
Урок 31
Тема. Ферум. Залізо. Фізичні та хімічні властивості заліза: взаємодія з киснем, сіркою
Цілі: поглибити знання про елементи-метали та прості речовини на прикладі Феруму та заліза; ознайомити учнів з фізичними та хімічними властивостями заліза на прикладі його взаємодії з киснем і сіркою; розширити знання про реакції сполучення на прикладі реакцій заліза з простими речовинами.
Тип уроку: засвоєння навичок і вмінь.
Форми роботи: фронтальна бесіда, самостійна робота з опорною
Обладнання: колекція “Залізо, чавун, сталь”, опорна схема “Залізо та його властивості”, хімічні реактиви, ложка для спалювання речовин, залізо відновлене, порошок сірки, кисень у склянці, нагрівальний прилад.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань
1. Хімічний диктант
Запишіть назви хімічних елементів у два стовпчики: окремо метали, окремо неметали.
Na, S, O, Fe, Cu, N, Ca, Mg, P, Cl, Ba, K.
Після виконання завдання два учні записують відповідь на дошці, клас коригує помилки.
2. Фронтальне опитування
– Чи відрізняються метали й неметали
– Чим метали й неметали відрізняються за фізичними властивостями?
– Чим відрізняються метали й неметали за хімічними властивостями? Метали відомі здавна. Ще зі стародавності люди знали сім металів: Au, Ag, Hg, Cu, Sn, Fe, Pb.
Люди вміли одержувати їх і широко використовували у своєму житті.
– Де давні люди використовували вироби з металів?
– А де використовуються металеві вироби сьогодні?
– Який метал використовується нами найширше? (Залізо)
Отже, об’єкт нашого дослідження – залізо. Записуємо тему уроку, формулюємо цілі.
ІІІ. Засвоєння нових навичок і вмінь
Хімічний елемент: Fe – Ферум.
Порядковий номер: 26.
Відносна атомна маса: 56.
Будова атома: +26)))) 26е – np = 26; ne – = 26; nn = 30.
Валентність: II або III.
Проста речовина: Fe – залізо.
Відносна молекулярна маса: 56.
Лабораторний дослід 4. Вивчення фізичних властивостей заліза
Інструктаж з техніки безпеки
Дослід 1. Розгляньте зразки заліза в колекції й опишіть фізичні властивості заліза за планом:
– агрегатний стан (твердий);
– колір (сірий);
– блиск (є);
– запах (немає);
– твердість (твердий, тугоплавкий);
– дія магнітом (має магнітні властивості).
Tпл = 1539 °С
Tкип = 3 200 °С
?(Fe) = 7,874 г/см3
Дослід 2. Вивчення розчинності заліза у воді
Шматочок заліза занурте в пробірку з водою. Що відбувається? Закріпіть пробірку в пробіркотримачі. Дотримуючись правил нагрівання, прогрійте пробірку, а потім акуратно підігрійте до кипіння і приберіть з вогню. Що сталося зі шматочком заліза? (Не розчиняється у воді) Зробіть висновок про фізичні властивості заліза.
Вивчені нами експериментально фізичні властивості заліза записуємо до опорної схеми. (Самостійна робота з опорною схемою)
IV. Демонстраційний експеримент
Хімічні властивості заліза розглянемо на прикладі взаємодії заліза з неметалами: киснем і сіркою.
Демонстрація 16. Взаємодія заліза із сіркою
Змішуємо порошок сірки й відновленого заліза в співвідношенні 4 г : 7 г, насипаємо в пробірку і трохи нагріваємо. Що спостерігаємо? Утворюється продукт взаємодії заліза із сіркою – ферум(ІІ) сульфід. Запишемо рівняння хімічної реакції.
Fe + S = FeS
До спіралі із залізного дроту прикріплюємо сірник, підпалюємо й опускаємо дріт у банку з киснем (на дно банки попередньо насипаємо пісок). Що спостерігаємо?
Щоб записати рівняння реакції, необхідно згадати, що Ферум у сполуках виявляє дві валентності – ІІ і ІІІ, отже, може утворюватися два оксиди. Складемо відповідні рівняння реакції:
2Fe+O2  2FeO – ферум(ІІ) оксид
2FeO – ферум(ІІ) оксид
4Fe+3O2  2Fe2O3 – ферум(ІІІ) оксид
2Fe2O3 – ферум(ІІІ) оксид
Обидва оксиди можуть утворюватися в результаті горіння заліза. Тому бура маса, що утворилася в результаті горіння, виражається формулою Fe3O4 = Fe2O3 – FeO.
Тоді
3Fe+2O2 = Fe3O4
Висновок: залізо, як і більшість металів, взаємодіє з неметалами (сіркою і киснем).
Залізо розчиняється в кислотах. При цьому виділяється водень:
Fe+2HCl = FeCl2 + H2
Залізо утворює сплави (чавун, сталь та ін.).
Самостійно учні заповнюють опорну схему.
V. Закріплення нових знань
1. Обчисліть масову частку Феруму в його оксидах.
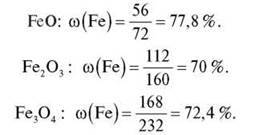
2. Горіння ферум(ІІ) сульфіду можливе за високої температури. Запишіть рівняння реакції:
3FeS + 5O2  Fe3O4 + 3SO2
Fe3O4 + 3SO2
3. Запишіть рівняння реакції взаємодії заліза з хлором.
2Fe + 3Cl2  2FeCl3
2FeCl3
VI. Підбиття підсумків
Ми познайомилися з фізичними та хімічними властивостями заліза – представника елементів-металів.
– Які фізичні властивості властиві залізу?
– З якими хімічними властивостями заліза ми сьогодні познайомилися?
VII. Домашнє завдання
Прочитати параграф, відповісти на запитання.
Творче завдання. Підготувати повідомлення про поширення заліза в природі.
Скласти схему “Застосування заліза та сполук Феруму”.