Місце неметалічних елементів у періодичній системі, особливості будови атомів. Фізичні властивості неметалів. Поширення в природі
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
Урок 5
Тема уроку. Місце неметалічних елементів у періодичній системі, особливості будови атомів. Фізичні властивості неметалів. Поширення в природі
Цілі уроку: розвивати й поглиблювати знання учнів про періодичну систему на прикладі неметалічних елементів; показати загальні закономірності та істотні відмінності у властивостях неметалічних елементів, будові та властивостях їхніх сполук, поширення в природі.
Тип уроку: засвоєння нових знань.
Форми роботи:
Обладнання: періодична система хімічних елементів, таблиця розчинності, колекція мінералів, таблиці фізичних властивостей галогенів, халькогенів, підгрупи Нітрогену, підгрупи Карбону.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Фронтальна бесіда за питаннями
– Яких елементів – металів чи неметалів – у природі більше?
– У яких групах періодичної системи розташовуються неметалічні елементи?
– Чи можна зарахувати до неметалічних елементів
– У якій групі періодичної системи розміщені галогени? Назвіть їх.
– Які елементи-неметали в періодичній системі називаються “халькогенами”? Назвіть їх.
– Назвіть елементи п’ятої групи періодичної системи, які належать до неметалічних.
– У четвертій групі періодичної системи розташовані два елементи-неметали. Назвіть їх.
III. Вивчення нового матеріалу
1. Особливості будови атомів елементів-неметалів
Завдання 1 (четверо учнів біля дошки). Зобразіть схему будови атомів Карбону, Нітрогену, Оксигену, Флуору, укажіть вищий і нижчий ступені окиснення:
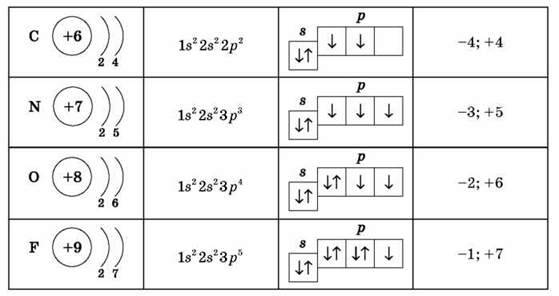
1) Що спільного в будові атомів цих елементів? (Це р-елементи, однакова кількість енергетичних рівнів, незавершений зовнішній енергетичний рівень, число електронів на зовнішньому рівні перевищує 3)
2) У чому полягають відмінності в будові атомів цих елементів? (Збільшується число електронів на зовнішньому рівні, а отже, й електронегативність, неметалічні властивості)
3) Як змінюються неметалічні властивості в підгрупах? Чому? (Зменшуються неметалічні властивості: унаслідок збільшення радіуса атома слабшає зв’язок між зовнішнім енергетичним рівнем і ядром атома. У III періоді з’являється вільний 3d-підрівень, що відіграє важливу роль у формуванні зовнішнього енергетичного рівня й утворенні хімічних зв’язків, а отже, впливає на властивості елементів)
Завдання 2 (самостійна робота). Складіть схеми будови атомів Силіцію, Фосфору, Сульфуру, Хлору, укажіть вищий і нижчий ступені окиснення.
Завдяки наявності d-підрівня в цих елементів можливий перерозподіл електронів на цей підрівень, стійкі сполуки з проміжними ступенями окиснення для Сульфуру +4, Фосфору +3, Хлору – +1, +3, +5.
Завдання 3 (групова або фронтальна робота). За таблицями 1, 2, 3, 4 порівняйте агрегатні стани та фізичні властивості простих речовин, утворених елементами-неметалами.
Назвіть загальні закономірності. (Низькі температури кипіння і плавлення, крихкість, неелектроліти, нерозчинні або малорозчинні у воді)
Назвіть відмінності у фізичних властивостях. (Агрегатні стани: газ (хлор, кисень, азот та ін.), рідини (бром), тверді речовини (вуглець, силіцій, фосфор та ін.), мають різні значення густини, смак, колір, запах, прості речовини мають різне число атомів, явище алотропії)
2. Поширення елементів-неметалів у природі
За таблицями порівняйте поширення елементів-неметалів у природі (лабораторна робота, повідомлення учнів).
Розглядаємо колекції мінералів, супроводжуючи перегляд розповіддю вчителя й демонстрацією фрагментів.
1) Поширення Сульфуру в природі
Вільна кристалічна сірка у вигляді сірчаних жил може залягати в тріщинах Землі вулканічних місцевостей (Італія, Греція) та
Всередині кратерів вулканів. Сірка здавна вважалася продуктом життєдіяльності “бога вулканів”. Це уявлення про сірку навіювали гарне синьо-блакитне полум’я, яким горить сірка, та задушливий запах. Поклади сірки знаходяться в Туркменії (Каракуми), по берегах Волги, в Узбекистані.
У складі складних речовин Сульфур міститься у водах Світового океану у вигляді солей (MgSO4, Na2SO4 та ін.), як і Оксиген, він необхідний для живих організмів, входить до складу білків.
Найважливіші природні сполуки Сульфуру:
– FeS2 – пірит
– CuSO4 – 5H2O – мідний купорос
– PbS – свинцевий блиск
– Na2SO4 – 10H2O – глауберова сіль
– Cu2S – мідний колчедан
– CaSO4 – 2H2O – гіпс
– ZnS – цинкова обманка
2) Нітроген у природі
Академік Прянішніков так охарактеризував азот: “Низка протилежностей пов’язана зі словом “Нітроген”: з одного боку, це “безжиттєвий газ”, а з іншого – немає життя без елемента Нітрогену, тому що він є невід’ємною складовою білків”.
Водночас Нітроген – елемент руйнування, тому що широко використовувані вибухові речовини є переважно сполуками Нітрогену.
Загальний уміст Нітрогену в земній корі становить близько 0,03 %. Основна його частина міститься в атмосфері – 75 % N2. Складні органічні похідні Нітрогену входять до складу всіх живих організмів. У результаті відмирання цих організмів утворюються більш прості сполуки Нітрогену, які за відсутності вологи можуть накопичуватися. (Таким є походження чилійської селітри.)
3) Фосфор у природі
Основні руди: апатит – [Ca5X(PO4)3] (X – F-, Cl-, OH-), фосфорит – Ca3 (PO4)2.
Фосфор становить 0,04 % від загальної кількості атомів земної кори. Входить до складу нервової та мозкової тканин, кісток
І зубів. Скелет дорослої людини містить у формі сполук близько 600 г Фосфору, м’язи – 56 г, нерви й мозок – 5 г (такої кількості чистого фосфору достатньо для смертельного отруєння 6,5 тисяч осіб). разом з тим, таке захворювання, як ламкість кісток, пов’язане з нестачею одночасно двох хімічних елементів – Фосфору й Кальцію.
4) Поширення в природі Карбону
Уміст Карбону в земній корі – 0,14 % від загальної кількості атомів. Карбон трапляється в природі у вільному стані у вигляді вугілля, алмаза, графіту, а також у складі складних речовин: тканин живих організмів і продуктів їх руйнування (вугілля, нафта, газ), мінералів (карбонати MeCO3, CaCO3 – кальцит); в атмосфері – у вигляді вуглекислого газу CO2 (також розчинений у природній воді).
Тпл = 3 750 °С (12 МПа) – графіт.
Сучасну назву Карбон одержав у 1787 році.
У природі трапляється у вигляді двох ізотопів: 12С (98,892 %) і 13C (1,108 %).
5) Поширення в природі Силіцію
Силіцій – найближчий аналог Карбону, третій після Оксигену й Гідрогену за поширенням елемент, становить 16,7 % від загальної кількості атомів земної кори. Si – основний елемент земної кори (силікатні породи, пісок – SiO2). Якщо Карбон уважають основою живої природи, то Силіцій – основа неживої природи. Земна кора більш ніж наполовину складається із SiO2. Вільний SiO2 – кварц: прозорий, чистий – гірський кришталь, фіолетовий – аметист, з домішками інших речовин – пісок. Інші природні сполуки – яшма, агат (напівкоштовні камені). Ткип = 3 300 °С, Тпл = 1 420 °С (кристалічний силіцій).
У природі існують три ізотопи: 28Si (92,2 %), 29Si (4,7 %), 30Si (3,1 %).
IV. Підбиття підсумків уроку
Учитель узагальнює особливості будови та фізичні властивості елементів-неметалів:
1) Доведіть, що за кількістю атомів неметалів у природі менше, але за вмістом (у відсотковому співвідношенні) їх значно більше й у повітрі, і у воді, і в земній корі, і в космосі.
2) Чим зумовлені відмінності у властивостях неметалів?
3) Які загальні закономірності у фізичних і хімічних властивостях неметалів ви можете назвати?
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: підготувати короткі повідомлення про природні сполуки неметалів.
Таблиця 1
Порівняльна характеристика властивостей галогенів
Характеристика | Флуор | Хлор | Бром | Іод | Астат |
Хімічний символ | F | Cl | Br | I | At |
Формула простої речовини | F | Cl2 | Br2 | І2 | At2 |
Атомна маса | 19,00 | 35,45 | 79,90 | 126,90 | [210] |
Порядковий номер | 9 | 17 | 35 | 53 | 85 |
Вищий ступінь окиснення | +7 | +7 | +7 | +7 | |
Нижчий ступінь окиснення | -1 | -1 | -1 | -1 | -1 |
Електронегативність | 4,0 | 3,0 | 2,8 | 2,5 | 2,2 |
Густина, г/см3 | 1,11 | 1,56 | 3,12 | 4,94 | |
Температура плавлення, °С | -220 | -101 | -7 | 114 | |
Температура кипіння, °С | -188 | -34 | 59 | 186 | |
Агрегатний стан (н. у.) | Газ | Газ | Рідина | Твердий | |
Колір | Зеленувато-жовтий | Жовто-зеленуватий | Червоно-бурий | Темно-фіолетовий | |
Уміст, %: | |||||
У земній корі | 0,066 | 0,017 | 2,1 – 10-4 | 4 – 10-5 | |
У повітрі | |||||
У воді |
Таблиця 2
Порівняльна характеристика властивостей халькогенів
Характеристика | Оксиген | Сульфур | Селен | Телур | Полоній |
Хімічний символ | O | S | Se | Те | Po |
Формула простої речовини | O2 | S8 | Se | Те | Po |
Атомна маса | 15,999 | 32,06 | 78,96 | 127,60 | [209] |
Порядковий номер | 8 | 16 | 34 | 52 | 84 |
Вищий ступінь окиснення | +6 | +6 | +6 | +6 | +6 |
Нижчий ступінь окиснення | -2 | -2 | -2 | -2 | -2 |
Електронегативність | 3,5 | 2,5 | 2,4 | 2,1 | 2,0 |
Густина, г/см3 | 1,429 | 1,96 | 4,79 | 6,25 | 9,4 |
Температура плавлення, °С | -218,7 | 112,8 | 217 | 449,8 | 254 |
Температура кипіння, °С | -182,98 | 440,6 | 685 | 990 | 962 |
Агрегатний стан (н. у.) | Газ | Твердий | Твердий | Твердий | Твердий |
Колір | Відсутній | Жовтий, білий, коричневий | Темно-коричневий, Червоно-коричневий | Сріблясто-білий | Сріблистий |
Уміст, %: | |||||
У земній корі | 47 | 0,047 | 5 – 10-6 | 1 – 10-7 | 2 – 10-14 |
У повітрі | 20,95 | ||||
У воді | 88,8 |
Таблиця 3
Порівняльна характеристика властивостей елементів V групи
Характеристика | Нітроген | Фосфор | Арсен | Стибій |
Хімічний символ | N | P | As | Sb |
Формула простої речовини | N2 | P4 | As | Sb |
Атомна маса | 14,00 | 30,97 | 74,92 | 121,75 |
Порядковий номер | 7 | 15 | 33 | 51 |
Вищий ступінь окиснення | +5 | +5 | +5 | +5 |
Нижчий ступінь окиснення | -3 | -3 | -3 | -3 |
Електронегативність | 3,0 | 2,1 | 2,0 | 1,9 |
Густина, г/см3 | 1,250 | 1,828 | 5,727 | 6,69 |
Температура плавлення, °С | -209,9 | 44,1 | 814(36 атм) | 630,5 |
Температура кипіння, °С | -195,8 | 5500 | 615 (сублімація) | 1640 |
Агрегатний стан (н. у.) | Газ | Твердий | Твердий | Твердий |
Колір | Відсутній | Жовтий, білий | Чорний | Сріблистий |
Уміст, %: | ||||
У земній корі | 1,9 – 10-3 | 0,093 | 1,7 – 10-4 | 5 – 10-5 |
У повітрі | 78,09 | |||
У воді |
Таблиця 4
Порівняльна характеристика властивостей елементів IV групи й Гідрогену
Характеристика | Карбон | Силіцій | Германій | Гідроген |
Хімічний символ | C | Si | Ge | H |
Формула простої речовини | C | Si | Ge | Н2 |
Атомна маса | 12,01 | 28,09 | 72,59 | 1,00 |
Порядковий номер | 6 | 14 | 32 | 1 |
Вищий ступінь окиснення | +4 | +4 | +4 | +1 |
Нижчий ступінь окиснення | -4 | -4 | -4 | -1 |
Електронегативність | 2,5 | 1,8 | 1,8 | 2,1 |
Густина, г/см3 | 3,515 (алмаз), 2,265 (графіт) | 2,328 | 5,327 | 0,0899 |
Температура плавлення,°С | 3 750 | 1 423 | 937,5 | -259,1 |
Температура кипіння,°С | 3 700 (12 атм) | 2 600 | 2 700 | -252,6 |
Агрегатний стан (н. у.) | Твердий | Твердий | Твердий | Газ |
Колір | Алмаз – безбарвний, вугілля – чорне, графіт – сірий | Темно-сірий | Ясно-сірий | Безбарвний |
Уміст, %: | ||||
У земній корі | 0,023 | 28,5 | 1,4 – 10-5 | 0,15 |
У повітрі | 0,0001 | |||
У воді | 11,4 |