Молярна маса
Тема 1
КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
УРОК 5
Тема. Молярна маса
Цілі уроку: увести поняття “молярна маса”; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв’язок між кількістю речовини, масою, молярною масою.
Тип уроку: комбінований.
Форми роботи: керована практика, самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
І. Організація класу
II. Перевірка домашнього
Керована практика. Розв’язання задач
Задача 1

2) За формулою  = N/NA;
= N/NA;
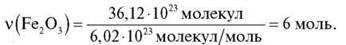
Відповідь: 6 моль.
Задача 2
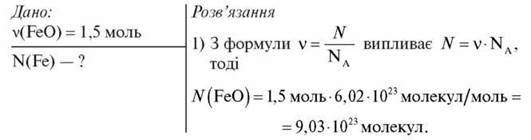
2) Оскільки в молекулі FeO одна молекула Феруму, то
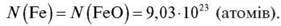
Відповідь: 9,03 – 1023 атомів.
III. Вивчення нового матеріалу
Скільки важить 1 моль речовини?
В 1 моль міститься 6,02 – 1023 частинок речовини. Кожна частинка має певну масу.
Молярна маса – це маса 1 моль речовини, а отже, сумарна маса всіх частинок, що входять в 1 моль цієї речовини.
Молярна
Молярна маса – це фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини.
Позначається Мm.
Mm = m/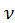 .
.
Одиниці вимірювання: кг/моль або г/моль.
Наприклад, маса 1 моль води дорівнює:

IV. Закріплення вивченого матеріалу
Знаючи масу речовини, ми можемо обчислити кількість речовини за формулою
 = m/Мm.
= m/Мm.
Задача 1
Обчисліть кількість речовини кисню в 64 г кисню.
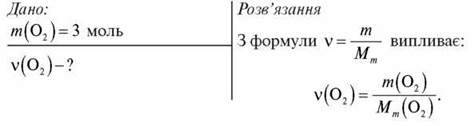
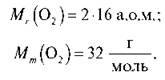
Тоді:
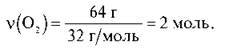
Відповідь: 2 моль.
Задача 2
Обчисліть масу 3 моль карбон(ІV) оксиду.
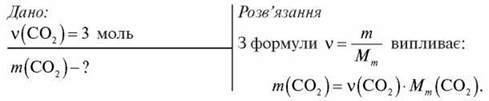
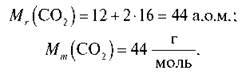
Тоді:
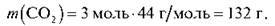
Відповідь: 32 г.
V. Самостійна робота з взаємоперевіркою
Обчисліть масу 5 моль:
Варіант І: натрій хлориду NaCl;
Варіант II: кальцій оксиду СаО.
Після виконання завдання учні обмінюються роботами й перевірять один одного.
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на питання, виконати вправи.
Творче завдання (домашня практика)
1. Обчисліть кількість речовини питної соди – натрій гідрогенкарбонату NaHCO3, в ложці соди масою 42 г.
2. Обчисліть масу 5 моль цукру (сахароза має формулу С12Н22О11).
Related posts:
- МОЛЯРНА МАСА. КІЛЬКІСТЬ РЕЧОВИНИ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ 1.4. МОЛЯРНА МАСА. КІЛЬКІСТЬ РЕЧОВИНИ Один моль – кількість речовини, у якій міститься стільки ж молекул або атомів, скільки в Карбоні 126С масою 0,012 кг. Стала Авогадро (NА) – число атомів або молекул в 1 молі будь-якої речовини: Згідно із законом […]...
- Кількість речовини. Стала Авогадро. Молярна маса Хімія Загальна хімія Основні поняття, закони й теорії хімії Кількість речовини. Стала Авогадро. Молярна маса Кількість речовини (n) – це визначене число будь-яких структурних одиниць (атомів, молекул, іонів тощо). Одиниця виміру кількості речовини – Моль. В 1 моль число будь-яких частинок дорівнює , тобто стільки ж, скільки міститься в 0,012 кг вуглецю. Це число визначене […]...
- Моль. Молярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.6. Моль. Молярна маса У Міжнародній системі одиниць (Сl) за одиницю кількості речовини прийнято моль. Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься […]...
- Кількість речовини, молярна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.7. Кількість речовини, молярна маса Кількість речовини п (або V, ню) – це фізична величина, яка визначає кількість частинок (молекул, атомів, йонів, йонних угруповань – асоціатів) у певній її порції. Одиницею вимірювання кількості речовини є моль. Моль – […]...
- Обчислення за хімічними формулами молярної маси й кількості речовини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 6 Тема. Обчислення за хімічними формулами молярної маси й кількості речовини Цілі уроку: поглибити уявлення учнів про молярну масу речовини; навчити використовувати набуті знання для обчислення за хімічними формулами молярної маси, маси й кількості речовини. Тип уроку: формування вмінь і навичок. Форми роботи: керована практика, самостійна […]...
- Визначення середньої молярної маси суміші газів – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач V. Визначення середньої молярної маси суміші газів Формули і поняття, які використовуються: Де М(суміші) – середня молярна маса суміші газів, М(А), М(Б), М(В) – молярні маси компонентів суміші А, Б і В, Χ(А), χ(Б), […]...
- Тематичне оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами” Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 10 Тема. Тематичне оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами” Цілі уроку: перевірити рівень знань учнів та їх уміння виконувати розрахунки з використанням понять “кількість речовини”, “молярна маса”, “молярний об’єм”, “відносна густина газу”; виявити рівень навчальних досягнень учнів з теми. Тип уроку: контроль знань, […]...
- Розрахунки за формулами для обчислення кількості речовини – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач І. Розрахунки за формулами для обчислення кількості речовини Формули і поняття, які використовуються: Де n(Х) – кількість речовини X, моль, M(Х) – маса речовини X, г, V(X) – об’єм газу X за нормальних умов, […]...
- Відносна густина газів. Обчислення відносної густини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 8 Тема. Відносна густина газів. Обчислення відносної густини Цілі уроку: розкрити суть поняття “відносна густина газів”; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків. Тип уроку: засвоєння нових знань. Форми роботи: розповідь учителя, керована практика, […]...
- Маса і розміри молекул. Кількість речовини ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 4 Тема. Маса і розміри молекул. Кількість речовини Мета: конкретизувати положення про масу молекул, відносну молекулярну масу, кількість речовин, молярну масу, число Авогадро. Обладнання: періодична система елементів Менделєєва. План уроку 1. Визначення маси молекул та її розмірів. 2. Для чого ввели відносну атомну масу речовин. 3. Поняття кількості […]...
- Обчислення масової частки й маси речовини в розчині Тема 1 РОЗЧИНИ Урок 8 Тема уроку. Обчислення масової частки й маси речовини в розчині Цілі уроку: закріпити знання про масову частку розчиненої речовини; формувати навички й уміння обчислювати масову частку розчиненої речовини, застосовувати ці знання для обчислення маси розчиненої речовини, приготування розчинів із заданою масовою часткою розчиненої речовини. Тип уроку: застосування знань, умінь і […]...
- Обчислення відносної густини газу – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач III. Обчислення відносної густини газу Формули і поняття, які використовуються: Де Dnов.(X) – відносна густина газу X за повітрям, DA(X) – відносна густина газу X за газом А, М(Х) – молярна маса газу X, […]...
- ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Речовини, що вступають в хімічну взаємодію, можуть складатися з атомів, або молекул, або інших частинок. Кількість речовини, що реагує, зручно характеризувати числом таких частинок. Одиницею кількості речовини, що визначає число частинок, з яких ця речовина складається, є моль. Кількість речовини, виражена в […]...
- Відносна атомна маса, молекулярна маса, формульна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.6. Відносна атомна маса, молекулярна маса, формульна маса Теоретична хімія має справу з атомами і молекулами, і вираження їхньої маси у грамах для розрахунків є незручним. Так, абсолютна маса атома Гідрогену становить 1,673 ·10-24 г, атома Сульфуру – […]...
- Відносна молекулярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.5. Відносна молекулярна маса Відносною молекулярною масою Мr речовини називається величина, що дорівнює відношенню середньої маси молекули природного ізотопічного складу речовини до маси атома карбону 12С. Відносна молекулярна маса чисельно дорівнює сумі відносних атомних […]...
- Розрахунки за рівняннями хімічних реакцій між розчином солі та металом РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 53. Розрахунки за рівняннями хімічних реакцій між розчином солі та металом Усвідомлення змісту цього параграфа дає змогу: Пояснювати суть і причини зміни маси пластинки в зазначених реакціях; Розв’язувати задачі “на пластинку”. Задачі такого типу засновані на закономірностях витискувального ряду металів. Як ви уже знаєте, показником порівняльної хімічної […]...
- Відносна молекулярна маса Розділ 1 Початкові хімічні поняття 15 Відносна молекулярна маса Матеріал параграфа допоможе вам: > з’ясувати, що таке відносна молекулярна маса; > навчитись обчислювати відносні молекулярні маси. Маси молекул, як і атомів, надзвичайно малі. Тому в хімії використовують відносні маси молекул. Їх зазвичай називають відносними молекулярними масами. Відносна молекулярна маса – це відношення маси молекули до […]...
- Визначення масової та об’ємної часток компонента в суміші – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач IV. Визначення масової та об’ємної часток компонента в суміші Формули і поняття, які використовуються: Де w(X) – масова частка цього компонента в суміші, Φ(Х) – об’ємна частка компонента X в суміші, M(X) – маса […]...
- Тема 2. Закон збереження маси. Кількість речовини – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 2. Закон збереження маси. Кількість речовини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте прізвище вченого, ім’ям якого названо число частинок, що міститься в 1 моль будь-якої речовини: A. Менделєєв; Б. […]...
- Тема 3. Газові закони. Закон Авогадро – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 3. Газові закони. Закон Авогадро Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте формулювання закону Авогадро: A. Об’єми газуватих речовин в хімічній реакції пропорційні їхнім масам; Б. В однакових об’ємах різних […]...
- ДЕЯКІ ФІЗИЧНІ ВЕЛИЧИНИ І ЇХ ОДИНИЦІ – ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ Хімія – універсальний довідник ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ У хімічних реакціях атоми не утворюються заново і не руйнуються. Цей факт відображають закони стехіометрії. Маса речовин, які вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції (закон збереження маси). Об’єми газів, що реагують, відносяться один до одного і до об’єму отриманих газів як прості […]...
- ВІДНОСНА МОЛЕКУЛЯРНА МАСА. МАСОВА ЧАСТКА ЕЛЕМЕНТА В СКЛАДНІЙ РЕЧОВИНІ № 1. Відносну молекулярну масу також визначають на основі порівняння маси молекули з масою 1/12 частини атома Карбону, ядро якого містить шість протонів і шість нейтронів, тобто з атомною одиницею маси. Відносна молекулярна маса речовини показує, у скільки разів маса молекули більша за атомну одиницю маси. Як і відносна атомна маса, відносна молекулярна маса є […]...
- Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 37 Тема. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Цілі уроку: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними; підготувати учнів до тематичного оцінювання. Тип […]...
- Приготування розчинів Тема 1 РОЗЧИНИ Урок 9 Тема уроку. Приготування розчинів Цілі уроку: формування навичок і вмінь приготування розчинів; розвиток навичок розв’язання задач із використанням поняття “масова частка розчиненої речовини”, розрахунків, пов’язаних із приготуванням розчинів. Тип уроку: застосування вмінь і навичок. Форми роботи: самостійна робота під керівництвом учителя, виконання тренувальних завдань. Обладнання: таблиця розчинності, картки-завдання. ХІД УРОКУ […]...
- МАСА. ЦЕНТР МАСИ Фізика підготовка до ЗНО комплексне видання МЕХАНІКА 2. ОСНОВИ ДИНАМІКИ 2.1. ОСНОВНІ ЗАКОНИ ДИНАМІКИ. СИЛА. РІВНОДIЙНА СИЛА 2.1.4. МАСА. ЦЕНТР МАСИ Маса – фізична величина, яка кількісно характеризує інертні властивості тіла. Інертність полягає в тому, що для зміни швидкості руху тіла даною силою потрібен деякий час. Чим більшим є цей час, тим інертнішим є тіло. […]...
- Відносна атомна маса. Відносна молекулярна маса Контрольні запитання № 1. Відносна атомна маса – це відношення маси атома даного елемента до 1/12 маси атома Карбону. Відносна молекулярна маса М показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону. Для речовин йонної будови хімічна формула відображає склад формульної одиниці. Тому для таких речовин використовують відносну формульну масу. № 2. […]...
- Відносна молекулярна маса речовини. Масова частка елемента в складній речовині Тема 1 Початкові хімічні поняття & 12. Відносна молекулярна маса речовини. Масова частка елемента в складній речовині Опанувавши цю тему, ви зможете: – розуміти поняття “відносна молекулярна маса”, “масова частка елемента в складній речовині”; – уміти обмислювати відносну молекулярну масу за формулами речовин, масову частку елемента в складній речовині; – формувати навички в обчисленнях за […]...
- Маса атома. Відносна атомна маса Розділ 1 Початкові хімічні поняття 10 Маса атома. Відносна атомна маса Матеріал параграфа допоможе вам: > з’ясувати відмінність між масою атома і відносною атомною масою; > порівнювати маси атомів. Маса атома. Важливою характеристикою атома є його маса. Майже вся маса атома зосереджена в ядрі. Електрони мають настільки малу масу, що нею зазвичай нехтують. Зважувати атоми […]...
- Обчислення кількості атомів (молекул) у певній кількості речовини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 4 Тема. Обчислення кількості атомів (молекул) у певній кількості речовини Цілі уроку: формувати вміння і практичні навички хімічних обчислень з використанням понять “кількість речовини”, “моль”, “стала Авогадро”. Тип уроку: формування вмінь і навичок. Форми роботи: керована практика, самостійна робота. Обладнання: Періодична система хімічних елементів Д. І. […]...
- Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 7 Тема. Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Цілі уроку: ознайомити учнів з поняттям “молярний об’єм”; розкрити особливості використання поняття “молярний об’єм” для газоподібних речовин; навчити учнів використовувати отримані знання для розрахунків об’ємів газів за нормальних умов. Тип уроку: комбінований. Форми роботи: розповідь […]...