Ненасичені вуглеводні (алкени, алкіни)
Хімія
Органічна хімія
Вуглеводні
Ненасичені вуглеводні (алкени, алкіни)
Ненасиченими Називаються вуглеводні, що мають хоча б один подвійний Або потрійний (кратний) карбон-карбонний зв’язоК.
Алкени
Вуглеводні, що належать до гомологічного ряду алкенів (ненасичених вуглеводнів ряду етилену), мають один подвійний карбон-карбонний зв’язок. У їхній назві суфікс – ан замінюється на – ен.
Наприклад: етен (етилен): 
пропен (пропілен): 
Перший представник гомологічного
Електронна формула:
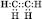
Структурна формула:
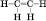
Загальна формула алкенів – CnH2n.
Алкіни
Ще один гомологічний ряд ненасичених вуглеводнів – алкінИ, що мають потрійні зв’язки. Назви алкінів походять від назв алканів, при цьому суфікс – ан заміщається на суфікс – ін.
Перший представник гомологічного ряду алкінів – ацетилен  .
.
Електронна формула: 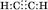
Структурна формула:

Загальна формула алкінів
 .
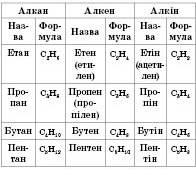
.Представники гомологічних рядів алканів, алкенів, алкінів
Ізомерія алкенів і алкінів
У ненасичених вуглеводнів крім ізомерії за вуглецевим кістяком З’являється новий вид ізомерії – ізомерія за положенням кратного зв’язкУ. Положення кратного зв’язку вказується цифрою наприкінці назви вуглеводню.
Наприклад:
 – бутен-1;
– бутен-1;
 – бутин-2.
– бутин-2.
Рахують атоми Карбону з того боку, до якого ближче кратний зв’язок. Наприклад:

4-метилпентен-1
Етилен й ацетилен
Фізичні властивості етилену й ацетилену. Гази без кольору й запаху, мало розчинні у воді, трохи легші за повітря.
Одержання ненасичених вуглеводнів.
1) Ненасичені вуглеводні можна одержати дегідруванням насичених. Реакція йде в присутності каталізаторів (платини або нікелю) і при нагріванні. Залежно від ступеня дегідрування можна одержати алкени або алкіни, а також здійснити перехід від алкенів до алкінів:



2) При крекінгу алканів виходить суміш алканів і алкенів, наприклад:

3) Ацетилен у промисловості й лабораторії одержують взаємодією кальцій карбіду з водою, реакція екзотермічна:

4) У промисловості ацетилен в основному одержують термічним розкладанням метану:

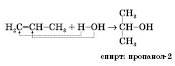
5) Дегідрогалогенування галогеналканів нагріванням зі спиртовим розчином лугу – лабораторний метод одержання ненасичених вуглеводнів:

Реакція йде за правилом ЗайцевА: Гідроген у реакціях розкладання відщеплюється від того атома Карбону, у якого найменша кількість атомів Гідрогену:

(Гідроген відщеплюється від  , але не від
, але не від  )
)
Хімічні властивості етилену й ацетилену. Для етилену і його гомологів характерні реакції, що йдуть із розривом однієї з подвійних сполук і приєднанням атомів за місцем розриву, тобто реакції приєднання.
1) Горіння (у достатній кількості кисню або повітря):


2) Гідрування (приєднання водню):

 ;
; 
3) Галогенування (приєднання галогенів):

 ;
; 
4) Гідрогалогенування (приєднання галогеноводнів):



Якісною реакцією на ненасичені вуглеводні Є знебарвлення бромної води або розчину калій перманганату. При взаємодії бромної води з ненасиченими вуглеводнями відбувається приєднання брому за місцем розриву кратних зв’язків і, відповідно, зникнення забарвлення, яке було зумовлене розчиненим бромом:

Правило МарковниковА: Гідроген приєднується до того атома Карбону, що зв’язаний з більшим числом атомів Гідрогену. Це правило можна показати на реакціях гідратації несиметричних алкенів і гідрогалогенування:
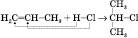
2-хлорпропан
При взаємодії галогеноводнів з алкінами приєднання другої молекули галогеноводню йде відповідно до правила МарковниковА:


Застосування етилену й ацетилену. Ненасичені вуглеводні використовують для синтезу багатьох органічних речовин. Етилен Використовують для одержання етилового спирту, поліетилену. Він прискорює дозрівання плодів. Ацетилен Використовують для автогенного зварювання металів.
Полімери
Для ненасичених сполук характерні реакції полімеризації. Полімеризація – це послідовне з’єднання молекул низькомолекулярної речовини з утворенням високомолекулярної речовини. При цьому з’єднання молекул відбувається за місцем розриву подвійних зв’язків.
Наприклад, полімеризація етилену:

Продукт полімеризації називається полімероМ, а вихідна речовина, що вступає в реакцію, – мономероМ; повторювані в полімері угруповання називаються структурними Або елементарними ланкамИ; число елементарних ланок у макромолекулі називається ступенем полімеризаціЇ.
Назва полімеру складається з назви мономера і префікса полі-, наприклад поліетилен, полівінілхлорид, полістирол.
Залежно від ступеня полімеризації з тих самих мономерів можна одержувати речовини з різними властивостями. Наприклад, поліетилен із короткими ланцюгами  є рідиною, що має мастильні властивості. Поліетилен з довжиною ланцюга в 1500-2000 ланок – твердий, але гнучкий пластичний матеріал, що йде на виготовлення плівки, посуду, пляшок. Поліетилен з довжиною ланцюга в 5-6 тис. ланок є твердою речовиною, з якого можна готувати литі вироби, труби.
є рідиною, що має мастильні властивості. Поліетилен з довжиною ланцюга в 1500-2000 ланок – твердий, але гнучкий пластичний матеріал, що йде на виготовлення плівки, посуду, пляшок. Поліетилен з довжиною ланцюга в 5-6 тис. ланок є твердою речовиною, з якого можна готувати литі вироби, труби.
У розплавленому стані поліетилену можна надати будь-якої форми, що зберігається після затвердіння. Така властивість називається ТермопластичністЮ.