Оцінювання навчальних досягнень учнів з теми “Розчини”
Тема 1
РОЗЧИНИ
Урок 20
Тема уроку. Оцінювання навчальних досягнень учнів з теми “Розчини”
Цілі уроку: узагальнити й систематизувати знання учнів з теми “Основні класи неорганічних сполук”; з’ясувати рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок.
Форми роботи: письмова контрольна робота за варіантами.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
I.
II. Письмова контрольна робота
Учитель розподіляє учнів за варіантами, нагадує їм зміст завдань, час виконання, правила оформлення відповідей і систему оцінювання:
– завдання 1-6 – тестові, кожне завдання оцінюється по 0,5 бала, у сумі перші шість завдань – 3 бали;
– завдання 7-9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Таким чином, максимальна оцінка за правильно виконану роботу становить 12 балів.
Час на виконання роботи –
III. Домашнє завдання
Повторити матеріал підручника про хімічні реакції.
Варіант І
1. Солі – це електроліти…
2. Маса речовини у 200 г розчину з масовою часткою речовини 10 %:
А) 20 г;
Б) 10 г;
В) 190 г.
3. Виберіть формули електролітів:
А) NaОH;
Б) MgCl2;
В) CО2;
Г) H2SО4.
4. За здатністю проводити електричний струм у розчинах речовини поділяються на типи:
А) насичені й ненасичені;
Б) електроліти й неелектроліти;
В) водні й неводні.
5. Установіть відповідність.
A. Ba(ОH)2 1. Ba2+, 2ОH-
Б. Na2SО4 2. 2H+, SО42-
B. H2SО4 3. 2Na+, SО42-
6. Процес електролітичної дисоціації:
А) оборотний;
Б) необоротний;
В) повільний.
7. Напишіть у іонній формі рівняння взаємодії:
А) натрій карбонату та хлоридної кислоти;
Б) аргентум нітрату й барій хлориду.
8. Підберіть два молекулярні рівняння до іонного рівняння: H+ + OH – 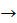 H2O
H2O
9. Обчисліть масову частку оцтової кислоти в розчині, одержаному в результаті розчинення 150 г кислоти у 200 г води.
10. Обчисліть масу осаду, одержаного в результаті взаємодії розчину купрум(ІІ) хлориду масою 120 г з масовою часткою солі 37,5 % і надлишку розчину натрій гідроксиду.
Варіант ІІ
1. Основи – це електроліти…
2. масова частка речовини в розчині, одержаному в результаті розчинення 10 г речовини у 200 г води:
А) 25 %;
Б) 5 %;
В) 15 %.
3. Виберіть формули електролітів:
А) CuSO4;
Б) HCl;
В) LiOH;
Г) C.
4. На розчинність речовин у воді впливає:
А) забарвлення розчину;
Б) природа речовини;
В) температура;
Г) агрегатний стан речовини.
5. Установіть відповідність.
A. CaCl2 1. H+, NO3-
Б. NaOH 2. Ca2+, 2Cl-
B. HNO3 3. Na+, OH-
6. Сильні електроліти в розчині:
А) дисоціюють поетапно;
Б) дисоціюють повністю;
В) не дисоціюють.
7. Напишіть у іонній формі рівняння взаємодії:
А) цинк сульфату й натрій гідроксиду;
Б) натрій карбонату й сульфатної кислоти.
8. Підберіть два молекулярні рівняння до іонного рівняння: Ba2+ + SO42- 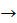 BaSO4
BaSO4
9. Обчисліть масу калій нітрату, яку необхідно розчинити у 120 г води для одержання розчину з масовою часткою речовини 10 %.
10. Обчисліть об’єм газу (н. у.), що виділиться внаслідок дії надлишку хлоридної кислоти на розчин натрій карбонату масою 400 г з масовою часткою 37,4 %.
Варіант ІІІ
1. Кислоти – це електроліти.
2. масова частка речовини в розчині, одержаному в результаті розчинення 20 г речовини в 100 г води:
А) 20 %;
Б) 10 %;
В) 17 %.
3. Виберіть формули електролітів:
А) S8;
Б) KCl;
В) НВr;
Г) Al2(SO4)3.
4. За вмістом розчиненої речовини розчини поділяються на типи:
А) насичені й ненасичені;
Б) істинні й колоїдні;
В) концентровані й розведені.
5. Установіть відповідність.
A. AgNO3 1. Ca2+, 2OH-
Б. H2SO4 2. 2H+, SO42-
B. Ca(OH)2 3. Ag+, NO3-
6. Електролітами є речовини з типами хімічного зв’язку:
А) ковалентний полярний, іонний;
Б) ковалентний неполярний, іонний;
В) ковалентний полярний, металічний.
7. Напишіть у іонній формі рівняння взаємодії:
А) натрій гідроксиду й нітратної кислоти;
Б) магній нітрату й калій гідроксиду.
8. Підберіть два молекулярні рівняння до іонного рівняння: Ag+ + Cl – 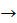 AgCl
AgCl
9. Обчисліть масу цукру й води, необхідних для приготування 180 г розчину з масовою часткою цукру 15 %.
10. Обчисліть масу сульфатної кислоти з масовою часткою 34 %, яку необхідно додати для нейтралізації розчину натрій гідроксиду масою 40 г з масовою часткою лугу 15 %.