Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
Приклади розв’язування типових задач
II. Розрахунки за рівняннями хімічних реакцій
Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду?
Дано:
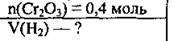
Розв’язання
Запишемо рівняння реакції:
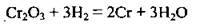
1. З написаного рівняння видно, що
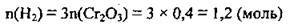
2. Для знаходження об’єму водню скористаємося формулою
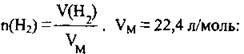
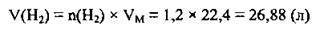
Відповідь: V(H2) = 26,88 л.
Задача 8. Яка маса алюмінію вступила в реакцію з хлоридною кислотою, якщо виділилось 2688 мл (н. у.) водню?
Дано:

Розв’язання
Запишемо рівняння реакції:
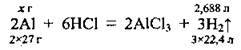
Складемо пропорцію: 54 г алюмінію відповідає 67,2 л водню, а х г алюмінію – 2, 688 л водню:
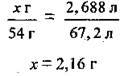
Відповідь: m(Аl) = 2,16 г.
Задача 9. Який об’єм кисню необхідно використати, щоб спалити 120 м3 суміші азоту і карбон(ІІ) оксиду, якщо об’ємна частка азоту в суміші становить 40 %?
Дано:
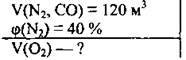
Розв’язання
1. У вихідній суміші горить лише карбон(ІІ) оксид, об’ємна частка якого:
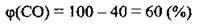
2. За формулою 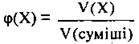 обчислимо об’єм карбон(ІІ) оксиду в суміші:
обчислимо об’єм карбон(ІІ) оксиду в суміші:
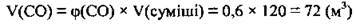
3. Запишемо рівняння реакції і, використавши закон об’ємних відношень, проведемо розрахунок:
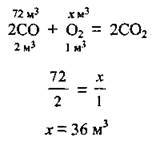
Відповідь: V(O2) = 36 м3.
Задача 10. Обчисліть об’єм газової суміші, що утвориться внаслідок термічного розкладання 75,2 г купрум(ІІ) нітрату.
Дано:
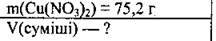
Розв’язання
Запишемо рівняння реакції:
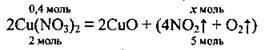
1. Розрахуємо кількість речовини купрум(ІІ) нітрату. M(Cu(NO3)2) = 188 г/моль:
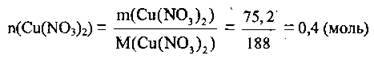
2. Проводимо розрахунок кількості речовин газів, які утворюються за рівнянням реакції:
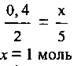
3. Обчислимо об’єм газової суміші. VM = 22,4 л/моль:
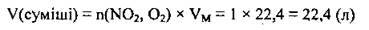
Відповідь: V(суміші) = 22,4 л.
Задача 11. Який об’єм сульфур(ІV) оксиду можна одержати при випалюванні 2,425 т цинкової обманки, масова частка цинк сульфіду в якій становить 80 %?
Дано:
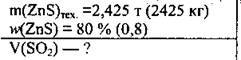
Розв’язання
1. Розрахуємо масу ZnS в цинковій обманці:
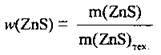
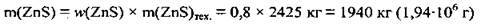
2. Складемо рівняння реакції, за яким і обчислимо об’єм SO2. M(ZnS) = 97 г/моль, VM = 22,4 л/моль:
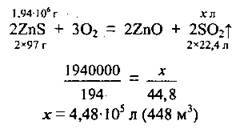
Відповідь: V(SO2) = 448 м3.
Задача 12. Обчисліть об’єм кисню, який можна одержати при повному термічному розкладанні 34 г розчину дигідроген пероксиду з масовою часткою Н2O2 30 %.
Дано:
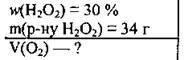
Розв’язання
1. Розрахуємо масу дигідроген пероксиду в розчині. М(Н2O2) = 34 г/моль:
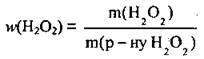
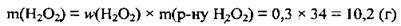
2. Складемо рівняння реакції і проведемо за ним розрахунок. VM = 22,4 л/моль:
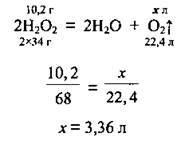
Відповідь: V(O2) = 3,36 л.
Задача 13. Яку масу технічного алюмінію з масовою часткою домішок 3 % необхідно використати для добування 2,5 моль заліза із залізної окалини?
Дано:
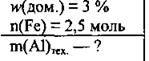
Розв’язання
1. Запишемо рівняння реакції і розрахуємо масу чистого алюмінію, яку необхідно використати на реакцію:
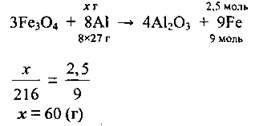
2. Оскільки алюміній містить 3 % домішок, то
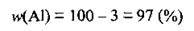
3. З формули 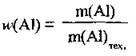 розрахуємо масу технічного алюмінію (тобто з домішками):
розрахуємо масу технічного алюмінію (тобто з домішками):
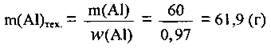
Відповідь: m(Аl)Тех. = 61,9 г.
Задача 14. Унаслідок нагрівання 107,2 г суміші калій сульфату і калій нітрату виділилось 0,1 моль газу. Обчисліть масу калій сульфату у вихідній суміші солей.
Дано:
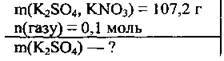
Розв’язання
1. Калій сульфат – речовина термічно стійка. Отже, під час нагрівання розкладається лише калій нітрат. Запишемо реакцію, кладемо пропорцію, визначимо кількість речовини калій нітрату, що розклалась:
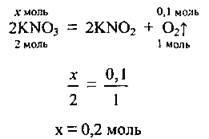
2. Обчислимо масу 0,2 моль калій нітрату. M(KNO3) = 101 г/моль:
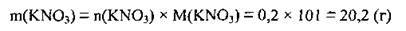
3. Обчислимо масу калій сульфату у вихідній суміші:
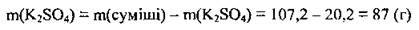
Відповідь: m(K2SO4) = 87 г.
Задача 15. При повному термічному розкладанні 0,8 моль алюміній нітрату одержали 35,7 г твердого залишку. Обчисліть відносний вихід речовини (%), що міститься у твердому залишку.
Дано:
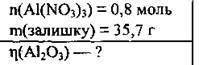
Розв’язання
1. Запишемо рівняння реакції розкладу алюміній нітрату. Складемо пропорцію, визначимо кількість речовини n(Аl2O3):
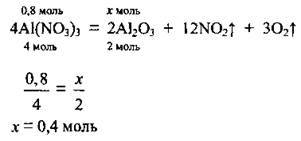
2. Розрахуємо масу утвореного оксиду. М(Аl2O3) = 102 г/моль:
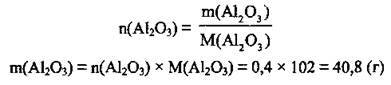
3. Розрахуємо відносний вихід Аl2O3 за формулою:
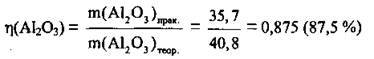
Відповідь: η(Аl2O3) = 87,5 %.
Задача 16. До повного розкладу нагріли 0,4 моль ферум(ІІІ) гідроксиду. Одержаний оксид відновили воднем і одержали 19,04 г заліза. Обчисліть відносний вихід заліза (%).
Дано:
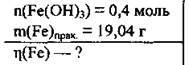
Розв’язання
1. Запишемо рівняння реакцій:
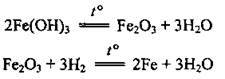
2. За рівняннями складаємо стехіометричну схему і за пропорцією визначимо теоретичний вихід заліза n(Fe)тeop.:
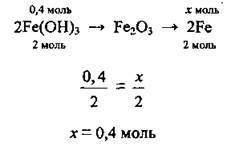
3. Обчислимо масу заліза, яку теоретично можна було б одержати, виходячи з проведених реакцій (M(Fe) = 56 г/моль):
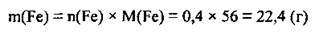
4. Розрахуємо відносний вихід заліза:
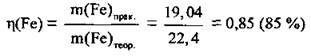
Відповідь: η(Fe) = 85 %.
Задача 17. При розчиненні у воді 23,4 г калію одержали 5,6 л газу (н. у.). Обчисліть відносний вихід цього газу (%).
Дано:
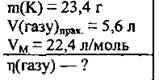
Розв’язання
1. Запишемо рівняння реакції й обчислимо об’єм водню, який теоретично, тобто згідно з рівнянням реакції, можна одержати з даної маси калію:
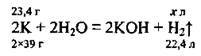
Складемо пропорцію:
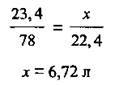
2. Обчислимо відносний вихід водню:
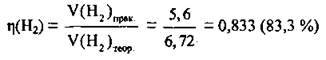
Відповідь: η(Н2) = 83,3 %.
Задача 18. При спалюванні 0,0168 м3 ацетилену одержали 55 г карбон(ІV) оксиду. Обчисліть відносний вихід вуглекислого газу (%).
Дано:
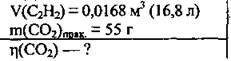
Розв’язання
1. Запишемо рівняння реакції горіння ацетилену, складемо пропорцію й обчислимо масу карбон(ІV) оксиду, яку можна одержати теоретично. VM = 22,4 л/моль, М(СО2) = 44 г/моль:
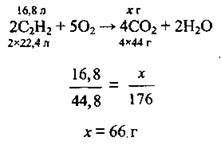
2. Обчислимо відносний вихід карбон(ІV) оксиду:
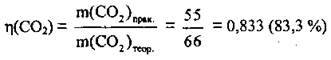
Відповідь: η(CO2) = 83,3 %.
Задача 19. У результаті каталітичного окиснення 5,8 моль аміаку одержали 0,112 м3 нітроген(ІІ) оксиду. Обчисліть відносний вихід одержаного оксиду (%).
Дано:
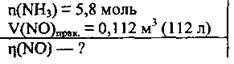
Розв’язання
1. Запишемо рівняння реакції каталітичного окиснення аміаку, складемо пропорцію й обчислімо об’єм нітроген(ІV) оксиду, який теоретично можна одержати (VM = 22,4 л/моль):
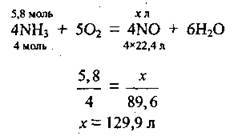
2. Розрахуємо відносний вихід нітроген(ІІ) оксиду:
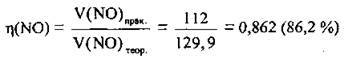
Відповідь: η(NO) = 86,2 %.
Задача 20. Крізь надлишок розчину калій гідроксиду пропустили 1,2 моль нітроген(ІV) оксиду. Одержали 0,55 моль калій нітрату. Обчисліть відносний вихід одержаної солі (%).
Дано:
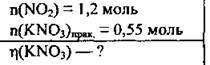
Розв’язання
1. Запишемо рівняння хімічної реакції, складемо пропорцію й обчислимо масу калій нітрату, яку теоретично можна одержати:
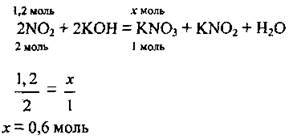
2. Обчислимо відносний вихід калій нітрату:
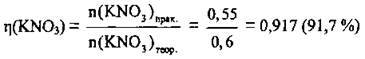
Відповідь: η(KNO3) = 91,7 %.
Задача 21. Яку масу амоній сульфату можна добути з 56 л аміаку, якщо відносний вихід солі становить 90 %.
Дано:
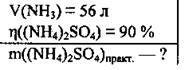
Розв’язання
1. Запишемо рівняння реакції, складемо пропорцію й обчислимо масу солі, яку теоретично можна одержати з 56 л NH3. VM = 22,4 л/моль M((NH4)2SО4) = 132 г/моль:
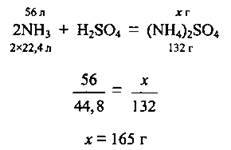
2. Обчислимо масу солі, яку можна одержати практично:
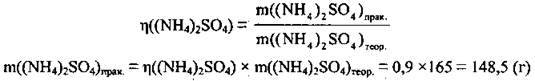
Відповідь: m((NH4)2SО4) = 148,5 г.
Задача 22. Хлором повністю окислили 1,4 моль заліза. Яку масу солі одержали, якщо її вихід становить 95 %?
Дано:
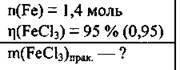
Розв’язання
1. Запишемо рівняння реакції і проведемо розрахунок маси солі, яку можна одержати теоретично. M(FeCl3) = 162,5 г/моль:
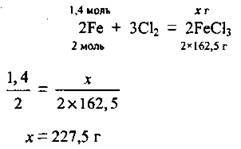
2. Розрахуємо масу FeCl3, яку одержали практично:
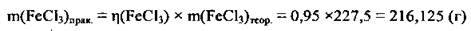
Відповідь: m(FeCl3)прак. ≈ 216 г.
Задача 23. До розчину, який містить 0,15 моль калій ортофосфату, долили розчин, у якому містилося 0,6 моль аргентум(І) нітрату. Визначте масу осаду, що утворився.
Дано:
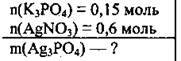
Розв’язання
1. Запишемо рівняння реакції (M(Ag3PО4) = 419 г/моль):
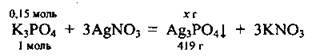
З нього видно, що для реакції з 0,15 моль К3РО4 потрібно 0,45 моль (0,15 · 3 = 0,45) аргентум(І) нітрату. Оскільки, згідно з умовами задачі, кількість речовини AgNО3 становить 0,6 моль, саме цю сіль взято в надлишку, тобто її частина залишається не використаною. Калій ортофосфат вступить у реакцію повністю, а тому вихід продуктів розраховуємо за його кількістю.
2. Складаємо пропорцію:
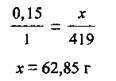
Відповідь: m(Ag3PО4). = 62,85 г.
Задача 24. У розчин, у якому містилось 58,4 г хлороводню, помістили 16,2 г алюмінію. Який об’єм газу (н. у.) виділився?
Дано:
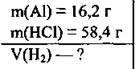
Розв’язання
1. Обчислимо кількість речовини алюмінію і хлороводню. М(Аl) = 27 г/моль, М(НСl) = 36,5 г/моль:
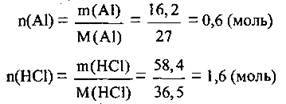
2. Запишемо рівняння реакції і встановимо речовину, яку взято в надлишку:
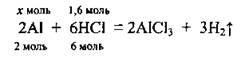
Розрахуємо кількість речовини алюмінію, яку можна розчинити в даній кількості хлоридної кислоти:
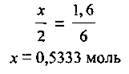
Отже, алюміній узято в надлишку: кількість його речовини (0,6 моль) є більшою за необхідну. Об’єм водню розраховуємо за кількістю речовини хлороводню.
3. Обчислимо об’єм водню, що виділився. VM = 22,4 л/моль:
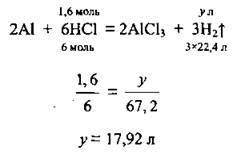
Відповідь: V(H2) = 17,92 л.
Задача 25. Суміш, яка містила 0,4 л ацетилену і 1200 мл кисню, привели до умов реакції. Який об’єм карбон(ІV) оксиду утворився?
Дано:
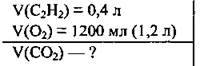
Розв’язання
Запишемо рівняння реакції:
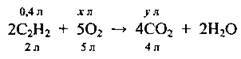
Згідно із законом об’ємних співвідношень, з наведеного рівняння випливає, що на кожні 2 об’єми С2Н2 витрачається 5 об’ємів O2 з утворенням 4 об’ємів карбон(ІV) оксиду. А тому спершу визначимо речовину, яка є в надлишку – перевіримо, чи вистачить кисню на спалювання ацетилену:
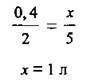
Оскільки за умовами задачі на спалювання ацетилену взято 1,2 л, а потрібно 1л, робимо висновок, що кисень взято в надлишку, а об’єм карбон(ІV) оксиду розраховуємо за об’ємом ацетилену, скориставшись законом об’ємних співвідношень газів:
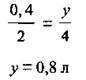
Відповідь: V(CO2) = 0,8 л.
Задача 26. Суміш, яка містить 80 мл сірководню і 120 мл O2, привели до умов реакції та одержали 70 мл сульфур(ІV) оксиду. Виміри об’ємів газів проводили за однакових умов. Обчисліть відносний вихід сульфур(IV) оксиду (%).
Дано:
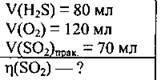
Розв’язання
1. Запишемо рівняння реакції горіння сірководню:
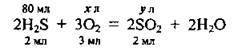
2. Перевіримо, чи вистачить кисню на спалювання 80 мл сірководню:
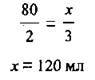
Отже, кисню вистачить, тому що його взято 120 мл у стехіометричній кількості. Надлишку жодної з речовин немає. А тому об’єм SO2 можна розрахувати за будь-якою з них:
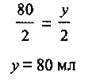
3. Обчислимо відносний вихід сульфур(ІV) оксиду:
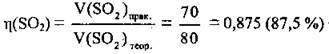
Відповідь: η(SO2) = 87,5 %.
Задача 27. При розчиненні у воді 0,28 г лужного металу виділилось 0,448 л водню (н. у.). Назвіть метал та вкажіть його протонне число.
Дано:
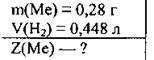
Розв’язання
1. Запишемо рівняння реакції (VM = 22,4 л/моль):
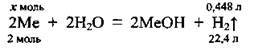
Складемо пропорцію і розрахуємо кількість речовини металу:
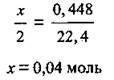
2. Обчислимо значення молярної маси металу, який вступив у реакцію:
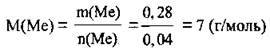
Це Літій. Протонне число Літію – 3.
Відповідь: Z(Me) = 3.
Задача 28. У результаті повного термічного розкладу 42,8 г гідроксиду тривалентного металічного елемента одержали 32 г твердого залишку. Укажіть молярну масу металічного елемента.
Дано:
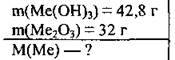
Розв’язання
1. Напишемо рівняння реакції у загальному вигляді:
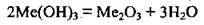
Оскільки єдиною відомою речовиною цієї реакції є вода, розрахунки будемо проводити за масою води, яка утворилась. Спираючись на закон збереження маси речовин, визначаємо її масу:
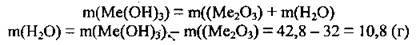
2. За рівнянням реакції проведемо розрахунок молярної маси гідроксиду металічного елемента. Молярну масу гідроксиду Ме(ОН)3 позначимо х г/моль (М(Н2O) =18 г/моль):
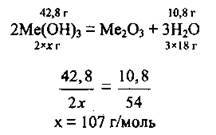
3. Обчислимо значення молярної маси металічного елемента:
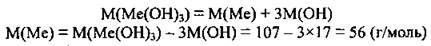
Це Ферум.
Відповідь: М(Ме) = 56 г/моль.
Задача 29. Купрум(ІІ) оксидом окислили 13,8 г насиченого одноатомного спирту й одержали 9,9 г альдегіду, відносний вихід якого становив 75 %. Назвіть спирт і вкажіть його молярну масу.
Дано:
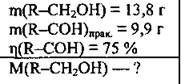
Розв’язання
Найоптимальніший варіант запису формули насиченого одноатомного спирту для написання рівняння реакції його окиснення – це R-CH2OH, де R – алкільний замісник, загальна формула якого СnН2n+1. Це зумовлено тим, що саме група – СН2ОН змінюється під час реакції окиснення, тобто переходить в альдегідну групу – СНО.
1. Запишемо рівняння реакції окиснення спирту до альдегіду в загальному вигляді:
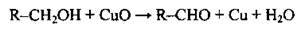
2. Обчислимо теоретичну масу альдегіду:
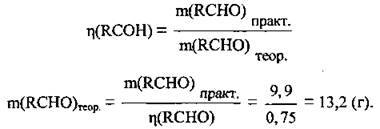
Для подальшого розв’язання цієї задачі можна використати 2 способи.
І спосіб (математичний спосіб, який передбачає виконання певної кількості арифметичних операцій).
Позначимо молярну масу алькільного замісника M(R) через х г/моль. Тоді:
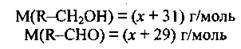
Складемо пропорцію й обчислимо молярну масу алкільного замісника:
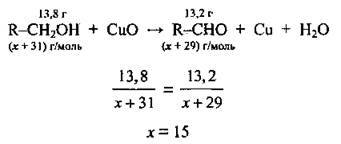
Отже, алкільний замісник – це метил – СН3, а спирт – етанол СН3-СН2-ОН; М(С2Н5ОН) = 46 г/моль.
II спосіб.
Обчислимо різницю молярних мас органічних продуктів згідно з рівнянням:
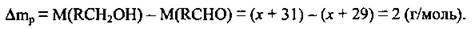
Згідно з умовою Δmр = 13,8 – 13,2 = 0,6 (г).
Складемо пропорцію: якщо в реакцію вступає 1 моль RCH2OH, то різниця мас становить 2 г, а якщо у моль RCH2OH, то різниця мас – 0,6 г.
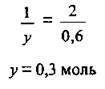
За формулою 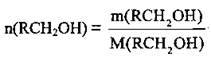 розрахуємо молярну масу спирту:
розрахуємо молярну масу спирту:
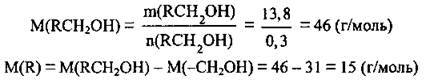
Отже, результат той самий.
Відповідь: М(С2Н5ОН) = 46 г/моль.
Задача 30. При повному зневодненні 87,5 г кристалогідрату ферум(ІІІ) нітрату одержали 1,5 моль водяної пари. Установіть формулу вихідної речовини.
Дано:
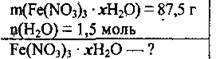
Розв’язання
1. Обчислимо масу 1,5 моль води, отриманої внаслідок реакції. М(Н2O) =18 г/моль:
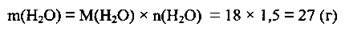
2. Виходячи із закону збереження маси, обчислимо масу солі, яку одержали при нагріванні кристалогідрату:
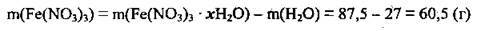
3. Розрахуємо кількість речовини Fe(NO3)3. M(Fe(NO3)3) = 242 г/моль:
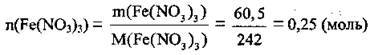
4. Обчислимо співвідношення кількостей речовини безводної солі і води:
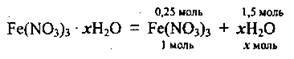
На 0,25 моль солі припадає 1,5 моль води, а на 1 моль солі – х моль:
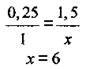
Відповідь: формула кристалогідрату – Fe(NO3)3 · 6Н2O.
Задача 31. Обчисліть об’єм кисню, необхідний для спалювання 160 м3 суміші карбон(ІІ) оксиду, азоту й етану, якщо об’ємні частки компонентів суміші відповідно становлять 50,0, 12,5 і 37,5 %.
Дано:
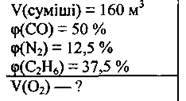
Розв’язання
1. За формулою 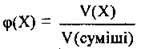 обчислимо об’єми горючих компонентів, а саме карбон(ІІ) оксиду й етану (зауважимо, що азот не горить):
обчислимо об’єми горючих компонентів, а саме карбон(ІІ) оксиду й етану (зауважимо, що азот не горить):
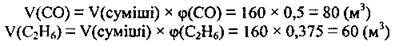
2. Напишемо рівняння реакцій горіння СО і С2Н6:
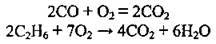
3. Скористаємося законом об’ємних співвідношень газів і проведемо розрахунок об’ємів кисню за кожним із рівнянь реакцій:
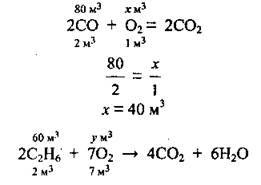
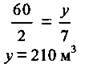
4. Обчислимо сумарний об’єм кисню:
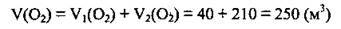
Відповідь: V(О2) = 250 м3.