Розв”язання типових задач
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ
§ 2.12 Розв”язання типових задач
Періодичний закон Д. І. Менделєєва, ізотопи
Задача 1. В якій групі і якому періоді періодичної системи елементів Д. І. Менделєєва перебуває елемент з порядковим номером 42?
Розв’язання. Розміщення елементів у періодичній системі відповідно до будови їх атомів таке: у першому періоді – 2, у другому – 8, у третьому – 8. Третій період закінчується
Задача 2. Який з елементів – натрій чи цезій – має більш виражені металічні властивості?
Розв’язання. Будову електронних оболонок атомів натрію і цезію можна зобразити так:
11Na 1s22s22p63s1, або скорочено 3s1;
55Cs 1s22s22p23s23p63d104s24p63d105s25p66s1, або 6s1.
Як бачимо, в обох атомів на зовнішньому
Задача 3. Які сполуки з гідрогеном утворюють елементи головної підгрупи VI групи? Назвіть найменш і найбільш міцні з них.
Розв’язання. Елементи головної підгрупи VI групи – р-елементи. В них на зовнішньому енергетичному рівні по 6 електронів: ns2np4. Отже, у сполуках з гідрогеном вони ви являють ступінь окиснення -2. Формули сполук: Н2О, H2S, H2Se, Н2Те, Н2Рo.
Зі збільшенням порядкового номера елемента (від оксигену до полонію) зростає радіус атома, що зумовлює зменшення міцності сполук з гідрогеном (від Н2О до Н2Рo). Отже, із зазначених сполук найміцнішою є вода Н2О, найслабкішою – Н2Ро.
Задача 4. Виходячи з місця в періодичній системі, опишіть хімічні властивості елемента з порядковим номером 23.
Розв’язання. За періодичною системою визначаємо, що елемент з порядковим номером 23 перебуває в IV періоді і в побічній підгрупі (V) групи. Цей елемент – ванадій V. Електронна формула ванадію:
1s22s22p63s23p63d34s2, або скорочено Зd34s2.
За електронною формулою доходимо висновку, що ванадій – d-елемент.
Елемент може легко віддавати 2 електрони з 4s-підрівня, виявляючи ступінь окиснення +2. При цьому він утворює оксид VO і гідроксид V(OH)2, що виявляють основні властивості. Газуватих водневих сполук ванадій не утворює, оскільки розміщений у побічній підгрупі.
Атом ванадію може також віддавати електрон з передостаннього d-підрівня (3 електрони) і, отже, виявляє вищий ступінь окиснення +5 (чисельно дорівнює номеру групи, в якій перебуває елемент). Оксид, що відповідає вищому ступеню окиснення, V2O5. Цей оксид виявляє кислотні властивості. Йому відповідає як гідроксид нестійка метаванадатна кислота HVO3 (солі її – ванадати – стійкі сполуки).
Задача 5. Елемент астат (ізотоп 21185At) був одержаний опромінюванням ізотопу бісмуту 20983Ві a-частинками (ядрами атома гелію). Напишіть рівняння ядерної реакції у повній і скороченій формах.
Розв’язання. Під час складання рівнянь ядерних реакцій необхідно враховувати закон збереження маси речовин (маса ми електронів нехтуємо). Крім того, заряди всіх частинок у лівій і правій частинах мають бути рівними. У лівій частині записуємо ядра, що взаємодіють, у правій – продукти реакції. Враховуючи порядкові номери і відносні маси атомів, записуємо схему реакції:
20983Ві + 42a -> 21185At + х.
Очевидно, частинка х повинна мати заряд 0 (оскільки 83+2=85) і атомну масу 209+4-211=2. Частинка із зарядом
0 – це нейтрон In, отже, має утворитися 2 нейтрони. Остаточний вид рівняння:
20983Вi + 42a -> 21182At+210n.
Або в скороченій формі:
209Вi (а, 2n) 211 At.
Будова електронних оболонок атомів
Задача 1. Напишіть електронну формулу елемента, атом якого містить на Зd-підрівні один електрон. В яких періоді, групі і підгрупі він перебуває і як цей елемент називається?
Розв’язання. Відповідно до шкали енергії (див. § 2.7 і рис. 2.3) 3d-підрівень заповнюється після заповнення підрівня 4s2:
1s22s22p63s23p64s23d1,
Або
1s22s22p63s23p63d14s2 (див. с. 50, виноска).
Загальне число електронів у атомі, яке визначає порядковий номер елемента в періодичній системі, – 21. Це – скандій. З електронної формули випливає, що цей елемент перебуває в IV періоді, третій групі (три валентних електрони 3d14s2), побічній підгрупі (елемент вродини).
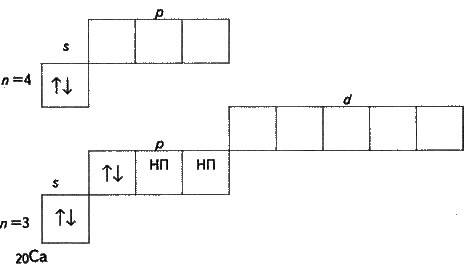
Задача 2. Складіть електронну формулу і скорочену електронну формулу елемента з порядковим номером 20. Зазначте розподіл електронів за квантовими комірками (орбіталями).
Розв’язання. За порядковим номером елемента доходимо висновку: в атомі 20 електронів. Зазначений елемент – кальцій. Електронна формула відповідно до принципу найменшої енергії (див. § 2.7) має вигляд:
1s22s22p63s23p64s2 (2 + 2 + 6 + 2 + 6 + 2) = 20.
Компактніше написання електронної формули – її називають скороченою електронною формулою – має вигляд: 4s2.
У ній та частина, яка відповідає заповненим енергетичним рівням благородного газу, позначається його символом (у квадратних дужках), а поряд зображується решта електронів.
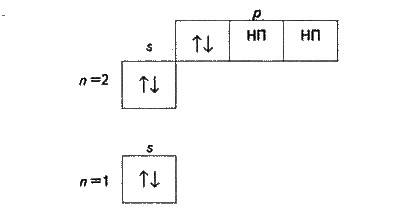
Електронній формулі атома кальцію відповідає такий розподіл електронів за орбіталями: