Розв’язування типових задач – ПІДГРУПА КАРБОНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 11. ПІДГРУПА КАРБОНУ
§11.10. Розв’язування типових задач
Задача 1. Під час прожарювання кристалогідрату CuSO4 ∙ 5Н2O масою 10,0 г відбулося часткове видалення води. Визначте формулу добутого кристалогідрату, якщо його маса дорівнює 7,84 г.
Розв’язання. Складаємо рівняння реакції:
CuSO4 ∙5Н2О = CuSO4 ∙ xН2О + (5 – х)Н2О,
Де х – кількість молів води, що містяться в 1 моль добутого кристалогідрату.
Розраховуємо кількість речовини
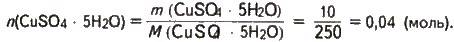
Кількість речовини добутого кристалогідрату також дорівнює 0,04 моль, тобто
N(CuSO4 ∙ xН2О) = 0,04 моль, що випливає з рівняння реакції процесу.
Кількість речовини води у вихідному кристалогідраті становить:
N(Н2O) = 5n(CuSO4 – 5Н2O);
N(Н2О) = 5 – 0,04 = 0,2 (моль).
Обчислюємо масу і кількість речовини води, видаленої з кристалогідрату і тієї, що залишилася в ньому:
Mвид(Н2O) = m(CuSO4 ∙ 5Н2О) – m(CuSO4 ∙ xН2О);
Mвид(н2O) = 10,0 – 7,84 = 2,16 (г);
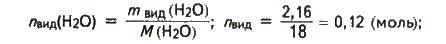
Nзал(Н2O) = n(Н2О) – nвид(Н2O);
Nзал(Н2О) = 0,2 – 0,12 = 0,08 (моль).
Розраховуємо
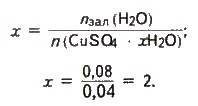
Таким чином, формула кристалогідрату – CuSO4 ∙ 2Н2О.
Задача 2. У процесі виробництва хлоридної кислоти хлороводень одержали, використовуючи хлор об’ємом 560 л (н. у.) і надлишок водню. Добутий газ розчинили у воді масою 4,175 кг. Визначте масову частку хлороводню в хлоридній кислоті.
Розв’язання. Визначаємо кількість речовини хлору, взятої для синтезу хлороводню:
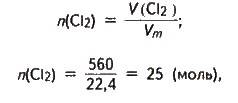
Де V(Сl2) – об’єм хлору за нормальних умов;
Vm – молярний об’єм газів за нормальних умов.
Із рівняння реакції синтезу хлороводню з простих речовин
Н2 + Сl2 = 2НСl
Виходить, що n( НСl) = 2n(Сl2);
N(НСl) = 2 ∙ 25 = 50 (моль),
Де n(НСl) – кількість речовини добутого хлороводню. Розраховуємо масу хлороводню, що утворився: m(НСl) = n(НСl) ∙ M (НСl);
M(НСl) = 50 36,5 = 1825 (г) = 1,825 (кг).
Обчислюємо масу добутого розчину:
M = m(HCl) + m(Н2O); m = 1,825 + 4,175 = 6 (кг). Визначаємо масову частку хлороводню в хлоридній кислоті:
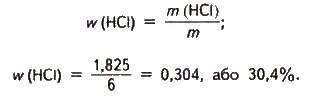
Задача 3. Наведіть приклади хімічних процесів, в яких:
А) кислота реагує з кислотою; б) слабка кислота витісняє сильну з розчину її солі.
Розв’язання, а) Кислота може реагувати з кислотою, якщо одна з кислот є окисником, а інша – відновником. Наприклад, іодоводнева кислота НІ (відновник) взаємодіятиме із сульфатною кислотою (окисник):
-1 +6 0 +4
2Нl + H2SO4 = l2 + SO4 + 2Н2О;
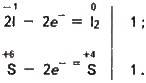
Сульфідна кислота H2S (відновник) окиснюватиметься нітратною кислотою HNO3:
H2S + 2HNO3 = S + 2NO2 + 2Н2О;
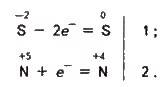
Б) Слабка кислота може витісняти сильну з розчину солі сильної кислоти, якщо один з продуктів реакції дуже мало розчинний у воді та кислотах. Наприклад, сульфідна кислота витіснить сульфатну з розчину сульфату купруму(ІІ):
CuSO4 + H2S = CuSi + H2SO4;
Cu2+ + H2S = CuSi + 2H+.
Ортофосфатна кислота витіснить сильнішу нітратну кислоту з розчину нітрату кальцію:
ЗСа(NО3)2 + 2Н3РO4 = Са3(РO4)2 ↓ + 6HNO3;
ЗСа2+ + 2Н3РО4 = Са3(РO4)2 ↓ + 6Н+.