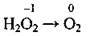Ступінь окиснення
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
3.9. Ступінь окиснення
Для запису окисно-відновних реакцій користуються поняттям ступеня окиснення.
Ступінь окиснення – це умовна величина заряду атома елемента, яка визначається з припущення, що речовина має йонний тип хімічного зв’язку, тобто спільна електронна пара повністю належить атому більш електронегативного елемента.
1. Ступінь окиснення елемента в простій речовині дорівнює нулю.
2.
3. Ступінь окиснення Оксигену – -2, крім сполуки з Флуором OF2 (+2) і пероксидів: Na2O2, К2O4, Н2O2 (-1).
4. Ступінь окиснення Гідрогену – +1, крім сполук з активними металічними елементами: КН, СаН2 (-1).
5. Ступені окиснення металічних елементів завжди позитивні +n (n – валентність металічного елемента:
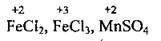
6. Ступені окиснення неметалічних елементів можуть бути як позитивними, так і негативними: 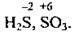
7. Арифметична сума ступенів окиснення всіх елементів сполуки дорівнює нулю.
8.
Пірит FeS2 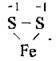 Ступінь окиснення Сульфуру – – 1, а валентність – II.
Ступінь окиснення Сульфуру – – 1, а валентність – II.
Гідроген пероксид Н2O2 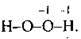 Ступінь окиснення Оксигену – -1, а валентність – II.
Ступінь окиснення Оксигену – -1, а валентність – II.
Ацетилен С2Н2 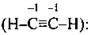 ступінь окиснення Карбону – – 1, а валентність – IV.
ступінь окиснення Карбону – – 1, а валентність – IV.
Ступінь окиснення елементів у сполуках, як видно з наведених вище прикладів, можна визначити і за графічною формулою.
9. Найвищий (позитивний) ступінь окиснення елемента, як правило, відповідає номеру групи в періодичній системі, де розміщений елемент (виняток: Оксиген не набуває ступеня окиснення +6, Флуор – ступеня окиснення +7). Мінімальний (негативний) ступінь окиснення неметалічного елемента визначають кількістю електронів, яких не вистачає до завершення зовнішнього електронного шару (до октету):
Номер групи Ступінь окиснення | І | II | III | IV | V | VI | VII |
Максимальний (позитивний) | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
Мінімальний (негативний) | – | – | – | -4 | -3 | -2 | -1 |
В одній молекулі різні атоми можуть набувати різних ступенів окиснення. Наприклад, у молекулі глюкози ступені окиснення атомів Карбону становлять -1, 0, +1. Арифметична сума ступенів окиснення всіх атомів, які входять до складу електронейтральної сполуки, дорівнює нулю:
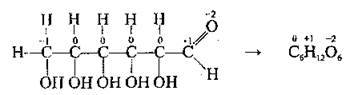
На відміну від заряду йона, при вказуванні ступеня окиснення спочатку ставлять знак, а потім числове значення: -3, -1, +2, +5… Ступінь окиснення вказують зверху над символом елемента.
Зміна ступенів окиснення під час перебігу окисно-відновних реакцій обумовлена повним або частковим переходом електронів від атомів (чи йонів) одного елемента до атомів (чи йонів) другого елемента. Закономірність зміни ступенів окиснення елементів у сполуках можна умовно подати за допомогою такого фрагмента числової осі:

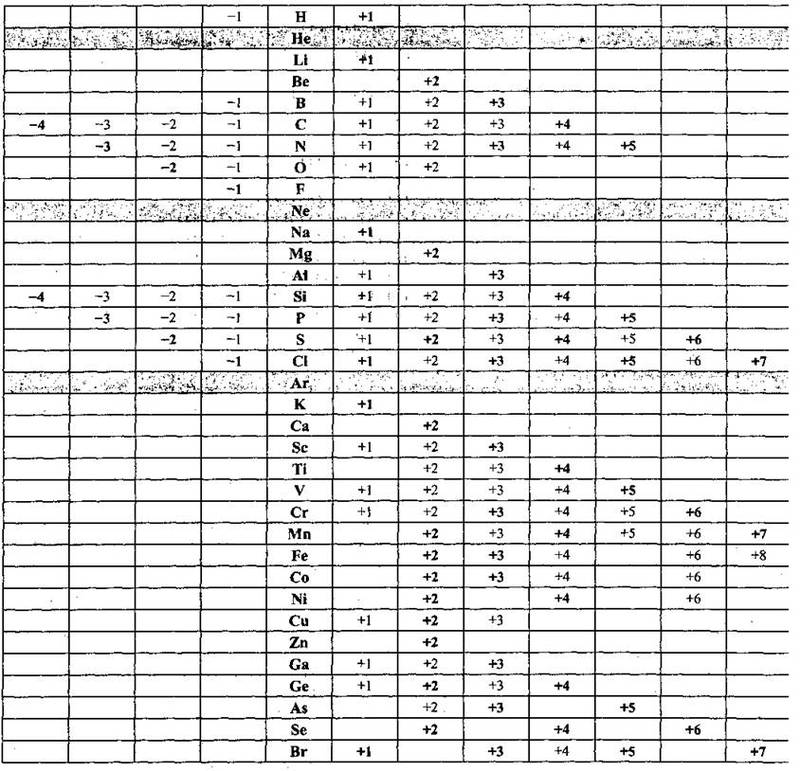
Нижче наведено таблицю, куди занесеш всі відомі ступені окиснення перших 35 хімічних елементів; найбільш характерні виділено напівжирним накресленням. Ступінь окиснення перших інертних елементів дорівнює нулю:
Приклади:
1. При зміні ступеня окиснення Нітрогену від +5 до -3 відбувається приєднання 8 електронів, що записують:
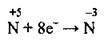 (відновлення)
(відновлення)
2. При зміні ступеня окиснення Сульфуру від +6 до +4 відбувається приєднання 2 електронів:
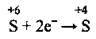 (відновлення)
(відновлення)
3. Нітроген змінює ступінь окиснення від -3 до +2:
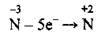 (окиснення)
(окиснення)
4. Сульфур змінює ступінь окиснення від -2 до +4:
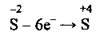 (окиснення)
(окиснення)
5. Кисень під час окисно-відновної реакції змінює ступінь окиснення від 0 до -2. При записі процесу відновлення враховують склад молекули кисню, а саме – те, що вона складається з двох атомів Оксигену1:
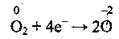 (відновлення)
(відновлення)
6. Хлор змінює ступінь окиснення від -1 до нуля (утворюється газ):
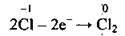 (окиснення)
(окиснення)
7. Азот змінює ступінь окиснення Нітрогену від нуля до -3:
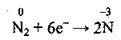 (відновлення)
(відновлення)
Найважливіші окисники і відновники
Що більша електронегативність елемента, то сильніші окисні властивості він виявляє.
Неметалічні (S, Cl, N, С) та низка металічних елементів (Fe, Mn, Cu, Pb, Cr) утворюють сполуки, виявляючи в них різні ступені окиснення, а тому в реакціях вони можуть виявляти різні властивості:
1) окисні, якщо ступінь окиснення елемента в сполуці високий (H2SO4 (конц.), HNO3, KMnO4, FeCl3);
2) відновні, якщо ступінь окиснення елемента низький (NH3, H2S, НСl);
3) при проміжних ступенях окиснення елемента (тих значеннях, що лежать між найнижчими і найвищими) він може виявляти і окисні, і відновні властивості (SO2; KNO2).
1. Якщо в склад речовини входить елемент з найвищим ступенем окиснення, то він може лише його знижувати. Отже, така речовина здатна приєднувати електрони, а тому в окисно-відновних реакціях вона виявляє лише окисні властивості, тобто є окисником. Наприклад:
– властивості нітратної кислоти HNO3 визначаються ітупенем окиснення Нітрогену (+5), а це найвищий ступінь окиснення для цього елемента;
– концентрована сульфатна кислота H2SO4 містить Сульфур з найвищим ступенем окиснення Сульфуру (+6), а тому може брати участь лише в процесах відновлення;
– властивості калій перманганату КМnO4 обумовлюються найвищим ступенем окиснення Мангану (+7), а тому калій перманганат може виявляти лише окисні властивості.
2. Якщо до складу речовини входить елемент з найнижчим ступенем окиснення, то він може його лише підвищувати. Тобто така речовина віддаватиме електрони, а тому в реакціях виявлятиме властивості відновника:
– сірководень H2S містить Сульфур з найнижчим ступенем окиснення (-2), а тому може лише віддавати електрони;
– аміак NH3 містить Нітроген з його найнижчим ступенем окиснення (-3), а тому він здатний лише до віддачі електронів.
3. Якщо до складу речовини входить елемент, що виявляє проміжний ступінь окиснення, то він може бути і окисником, і відновником:
– сульфур(ІV) оксид SO2 містить Сульфур з проміжним ступенем окиснення (-2 – найнижчий, +6 – найвищий), а тому він буде виявляти окисні чи відновні властивості залежно від реагенту, тобто речовини, з якою SO2 взаємодіє. Якщо ця речовина є типовим окисником, то сульфур(ІV) оксид виявлятиме відновні властивості:
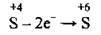 (окиснення)
(окиснення)
Якщо ж речовина-реагент є типовим відновником, то сульфур(ІV) оксид виявлятиме окисні властивості:
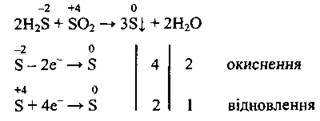
Типові окисники та продукти їхнього відновлення
Окисники | Приклади |
Прості речовини, утворені типовими неметалічними елементами |
|
Оксигеновмісні сполуки галогенів |
|
Оксигеновмісні сполуки Сульфуру |
|
Сполуки Нітрогену |
|
Сполуки Мангану |
|
Сполуки Хрому |
|
Сполуки металічних елементів, що містять металічний елемент з його найвищим ступенем окиснення |
|
Йони благородних металів |
|
Оксиди малоактивних металічних елементів |
|
Гідроген пероксид |
|
Типові відновники та продукти їхнього окиснення
Відновники | Приклади |
Метали, особливо лужні, лужноземельні, алюміній і цинк |
|
Сполуки металічних елементів, що містять атом металічного елемента з найнижчим ступенем окиснення |
|
Галогеноводневі кислоти та їхні солі |
|
Прості речовини, утворені неметалічними елементами |
|
Деякі сполуки Нітрогену та Фосфору |
|
Сполуки Сульфуру |
|
Сполуки Мангану |
|
Сполуки Хрому |
|
Гідроген пероксид |
|
___________________________________________________________________________
1 Якщо в процесі окиснення чи відновлення бере участь проста речовина, молекула якої складається з двох (Сl2, O2, N2, Н2, Вr2, I2) або трьох (O3) атомів, то в електронній схемі записують формулу цієї речовини.
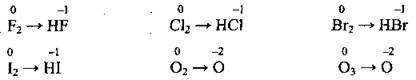

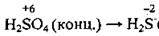 (3 активними металами К, Na, Са і з КI)
(3 активними металами К, Na, Са і з КI)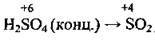 (з малоактивними металами Cu, Ag, Hg)
(з малоактивними металами Cu, Ag, Hg)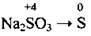 (у кислому середовищі)
(у кислому середовищі)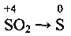
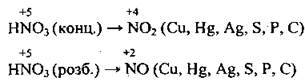
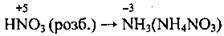 (з активними металами Ca, Mg, Na)
(з активними металами Ca, Mg, Na)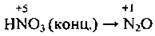 (з активними металами)
(з активними металами)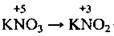 (лужне середовище)
(лужне середовище)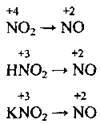 (кисле середовище)
(кисле середовище)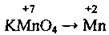 (у сульфатно-кислому середовищі утвоюється MnSO4)
(у сульфатно-кислому середовищі утвоюється MnSO4)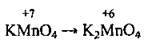 (у лужному середовищі)
(у лужному середовищі)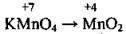 (у нейтральному середовищі)
(у нейтральному середовищі)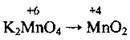 (у слаболужному середовищі)
(у слаболужному середовищі)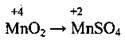 (у кислому середовищі)
(у кислому середовищі)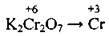 (у сульфатно-кислому середовищі утворюється Cr2(SO4)3)
(у сульфатно-кислому середовищі утворюється Cr2(SO4)3)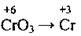

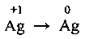
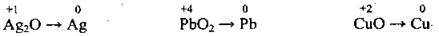
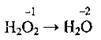
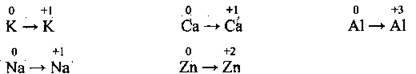
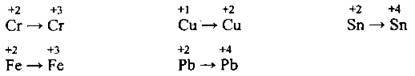

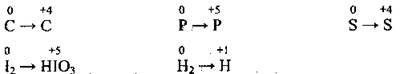
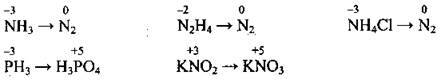
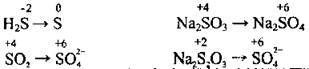
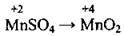 (нейтральне середовище)
(нейтральне середовище)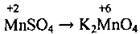 (лужне середовище)
(лужне середовище)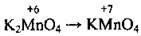 (нейтральне середовище)
(нейтральне середовище)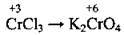 (лужне середовище)
(лужне середовище)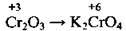 (лужне середовище)
(лужне середовище)