Тематична робота з теми “Хімічні реакції”
Тема 2
ХІМІЧНІ РЕАКЦІЇ
Урок 30
Тема уроку. Тематична робота з теми “Хімічні реакції”
Цілі уроку: узагальнити та скоригувати знання учнів з теми “Хімічні реакції”; з’ясувати рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок.
Форми роботи: письмова контрольна робота за варіантами.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
I. Організація класу
II.
Учитель розподіляє варіанти, нагадує учням зміст завдань, час виконання, ключові моменти оформлення відповідей і систему оцінювання:
– завдання 1-6 – тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань дають 3 бали;
– завдання 7-9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів (оцінюється в 3 бали).
Таким чином, максимальна оцінка за правильно виконану роботу становить 12 балів.
Час на виконання роботи – 40 хв.
Варіант І
1. Установіть
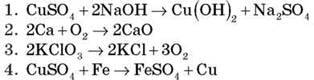
A. Розклад
Б. Сполучення
B. Заміщення
Г. Обмін
2. Укажіть рівняння ендотермічних реакцій:
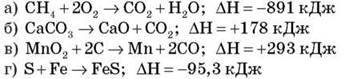
3. Виберіть сполуку, в якій Нітроген проявляє лише окисні властивості:
А) NH3;
Б) HNO3;
В) HNO2;
Г) NО2.
4. Речовина, що приєднує електрони в окисно-відновній реакції, називається:
А) відновником;
Б) ізотопом;
В) окисником;
Г) приймачем.
5. Теплота, що виділяється або поглинається в процесі хімічної реакції, називається.
A. Розклад
Б. Сполучення
B. Заміщення
Г. Обмін
6. Дано систему:
H2 + Cl2  2HCl
2HCl
Збільшення концентрації водню в системі:
А) змістить рівновагу вліво;
Б) змістить рівновагу вправо;
В) не вплине на зсув рівноваги.
7. Розставте коефіцієнти в рівнянні реакції методом електронного балансу, укажіть окисник і відновник:
Ca + HNО3  Ca(NО3)2 + N2 + H2О
Ca(NО3)2 + N2 + H2О
8. Обчисліть, у скільки разів збільшиться швидкість реакції внаслідок підвищення температури на 30 °С, якщо температурний коефіцієнт реакції дорівнює 2.
9. Обчисліть середню швидкість реакції, якщо за 5 хвилин концентрація однієї з вихідних речовин змінилася з 0,068 до 0,064 моль/л.
10. Обчисліть об’єм вуглекислого газу, що утвориться в результаті дії сульфатної кислоти на розчин калій карбонату масою 110 г з масовою часткою солі 25 %.
Варіант ІІ
1. Установіть відповідність.
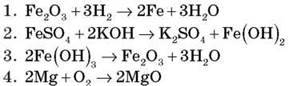
A. Розклад
Б. Сполучення
B. Заміщення
Г. Обмін
2. Укажіть рівняння ендотермічної реакції:
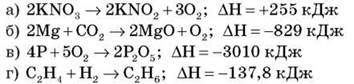
3. Виберіть сполуку, в якій Сульфур проявляє тільки відновні властивості:
А) Н2SО4;
Б) SО3;
В) SО2;
Г) Н2S.
4. До факторів, що прискорюють хімічну реакцію, належать:
А) підвищення температури;
Б) зміна забарвлення;
В) подрібнення;
Г) поява запаху.
5. Реакція, у результаті якої тепло виділяється, називається…
6. Дано систему:
3H2 + N2 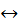 2H3N
2H3N
Зменшення тиску в системі:
А) змістить рівновагу вліво;
Б) змістить рівновагу вправо;
В) не вплине на зсув рівноваги.
7. Розставте коефіцієнти в рівнянні реакції методом електронного балансу, укажіть окисник і відновник:
Mg + H2SО4 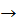 Mg2SО4 + S + H2О
Mg2SО4 + S + H2О
8. Обчисліть, на скільки градусів потрібно підвищити температуру, щоб швидкість реакції зросла в чотири рази, якщо температурний коефіцієнт реакції дорівнює 2.
9. Через 25 с після початку реакції концентрація однієї з вихідних речовин становила 0,5 моль/л, а через 50 с стала 0,1 моль/л. Обчисліть середню швидкість реакції.
10. Обчисліть масу осаду, що утвориться внаслідок дії достатньої кількості аргентум нітрату на 200 г розчину кальцій хлориду з масовою часткою 15 %.
Варіант ІІІ
1. Установіть відповідність.
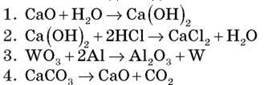
A. Розклад
Б. Сполучення
B. Заміщення
Г. Обмін
2. Укажіть рівняння ендотермічної реакції:
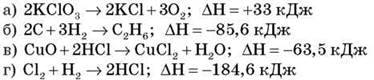
3. Виберіть сполуку, в якій Манган проявляє тільки окисні властивості:
А) KMnО4;
Б) MnSО4;
В) MnО2;
Г) K2MnО4.
4. Речовина, що прискорює хімічну реакцію, називається:
А) інгібітор;
Б) каталізатор;
В) підсилювач;
Г) реагент.
5. Реакція, у результаті якої тепло поглинається, називається…
6. Дано систему:
2SO2 + O2  2SO3
2SO3
Підвищення тиску в системі:
А) змістить рівновагу вліво;
Б) змістить рівновагу вправо;
В) не вплине на зсув рівноваги.
7. Розставте коефіцієнти в рівнянні реакції методом електронного балансу, укажіть окисник і відновник:
Cu + HNO3  Cu(NO3)2 + NO2 + H2O
Cu(NO3)2 + NO2 + H2O
8. Обчисліть, у скільки разів збільшиться швидкість хімічної реакції внаслідок підвищення температури на 30 °С, якщо температурний коефіцієнт реакції дорівнює 3.
9. Обчисліть середню швидкість реакції, якщо початкова концентрація однієї з речовин становила 0,015 моль/л, а через 10 хвилин зменшилася до 0,025 моль/л.
10. Обчисліть масу розчину хлоридної кислоти з масовою часткою 20 %, необхідну для нейтралізації розчину кальцій гідроксиду масою 120 г з масовою часткою 10 %.