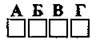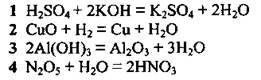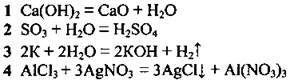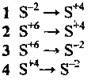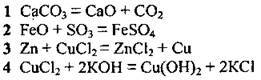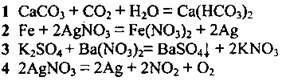Тести – Урок 4 – Хімічна реакція
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
Тести
4.1 Установіть відповідність реагентів з типом реакції, що між ними відбувається
Реагенти: | Тип реакції: |
1 магній оксид і нітратна кислота | А сполучення |
2 магній і хлор | Б заміщення |
3 магній і хлоридна кислота | В обмін |
4 магній нітрид і вода | Г розклад |
Д гідроліз |
4.2 Установіть відповідність між рівнянням реакції та типом реакції
Рівняння реакції: | Тип реакції: |
| А сполучення |
Б заміщення | |
В обмін | |
Г розклад | |
Д гідроліз |
4.3 Установіть відповідність між рівнянням реакції та типом реакції
Рівняння реакції: | Тип реакції: |
| А розклад |
Б заміщення | |
В | |
Г сполучення | |
Д обмін |
4.4 Укажіть пару речовин, реакція між якими є реакцією обміну
А цинк і сульфатна кислота
Б цинк гідроксид і сульфатна кислота
В цинк оксид і сульфур(VІ) оксид
Г калій оксид і вода
4.5 Укажіть формулу речовини, при нагріванні якої на повітрі відбувається реакція розкладу
A ZnS
Б КОН
В FeS2
Г Fe(OH)3
4.6 Термохімічне рівняння реакції розкладу кальцій карбонату:
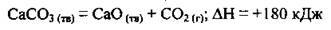
Укажіть, скільки теплоти виділиться чи поглинеться, якщо розкласти 0,2 моль кальцій карбонату
А поглинеться 36 кДж теплоти
Б виділиться 36 кДж теплоти
В поглинеться 9 кДж теплоти
Г виділиться 9 кДж теплоти
4.7 Термохімічне рівняння реакції окиснення нітроген(ІІ) оксиду:
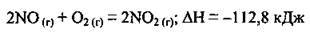
Укажіть об’єм нітроген(ІV) оксиду, який утворився, якщо виділилося 28,2 кДж теплоти
А 33,6 л
Б 22,4 л
В 16,8 л
Г 11,2 л
4.8 Укажіть рівняння ендотермічної реакції

4.9 Укажіть рівняння реакції, яка є окисно-відновною

4.10 У реакції, що описують рівнянням:
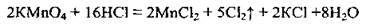
А Манган у калій перманганаті окислюється
Б Хлор у хлороводні відновлюється
В Гідроген у хлороводні відновлюється
Г Манган у калій перманганаті відновлюється
4.11 Укажіть найнижчий ступінь окиснення Брому
А -1
Б -2
В -3
Г -4
4.12 Укажіть формулу речовини, яка виступає в окисно-відновних реакціях лише як відновник
A H2S
Б S
В SО2
Г K2SO3
4.13 Укажіть формулу речовини, ступінь окиснення Сульфуру в якій +2
A K2SО4
Б K2S2О3
В K2SО3
Г K2S2О7
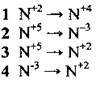
4.14 Якщо атом Нітрогену зі ступенем окиснення +5 приймає 8 електронів, то електронне рівняння цього процесу матиме вигляд
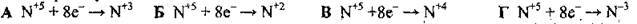
4.15 Установіть відповідність між схемою перетворення Та кількістю електронів, що беруть участь у процесі
Схема: | Кількість електронів: |
| A +2e- |
Б +6e- | |
В -8e- | |
Г +8e- | |
Д -6e- |

4.16 Установіть послідовність зростання ступеня окиснення Хлору в наведених формулах сполук
A NaClO4
Б Сl2O
В Са(Сl03)2
Г NaCl
4.17 Термохімічне рівняння реакції окиснення магнію:
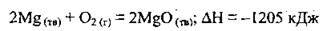
У результаті окиснення 0,4 моль магнію
А виділиться 4820 кДж теплоти
Б поглинеться 241 кДж теплоти
В виділиться 241 кДж теплоти
Г поглинеться 2410 кДж теплоти
4.18 У реакції, що описують рівнянням:
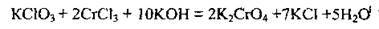
А окисник приймає 2 електрони
Б відновник приймає 4 електрони
В відновник віддає 8 електронів
Г окисник приймає 6 електронів
4.19 При зміні ступеня окиснення Карбону з -4 до +4 він
А приєднує 8 електронів
Б віддає 8 електронів
В віддає 4 електрони
Г приєднує 4 електрони
4.20 Укажіть рівняння окисно-відновної реакції
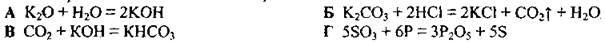
4.21 Укажіть, скільки електронів візьме участь у процесі, який описують схемою: 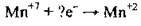
А 2
Б 5
В 7
Г 9
4.22 Укажіть формулу речовини, у складі якої Нітроген може бути лише відновником
A KNO3
Б N2O
В NO
Г Mg3N2
4.23 Укажіть рівняння реакції, у якій водень виступає як окисник

4.24 Укажіть речовину, яка виступає в окисно-відновних реакціях лише як окисник
A CrSO4
Б СrO3
В СrСl2
Г КСrO2
4.25 Установіть відповідність між схемою перетворення та кількістю електронів, що беруть участь у процесі
Схема: | Кількість електронів: |
| A +3e- |
Б +5e- | |
В +8e- | |
Г -2e- | |
Д -5e- |
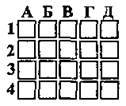
4.26 Установіть послідовність зростання ступеня окиснення Фосфору в наведених сполуках
А Н3РO2
Б Са3(РO4)2
В К3РO3
Г К3Р
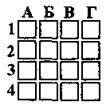
4.27 Укажіть схему окисно-відновної реакції, у якій сірка виступає окисником

4.28 Установіть відповідність між рівнянням і типом реакції
Рівняння реакції: | Тип реакції: |
| А розклад |
Б заміщення | |
В гідроліз | |
Г сполучення | |
Д обмін |
4.29 Укажіть сполуку, у якій Хлор виявляє максимальний (позитивний) ступінь окиснення
А СаСl2
Б КСlO3
В Сl2O
Г Ва(СlO4)2
4.30 У реакції, що описують рівнянням: 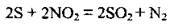
А Нітроген відновлюється
Б Нітроген окиснюється
В Оксиген окислюється
Г Сульфур відновлюється
4.31 Укажіть рівняння реакції, яка є окисно-відновною
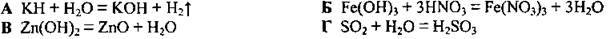
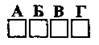
4.32 Укажіть правильно складену формулу сполуки Карбону з Флуором, у якій Карбон виявляє максимальний ступінь окиснення
A CF2
Б CF4
В C2F2
Г CF6
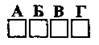
4.33 Установіть послідовність зменшення ступеня окиснення Сульфуру в сполуках, формули яких наведено
A SO2
Б CuS
В H2SO4
Г K2S2O3
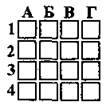
4.34 Укажіть речовину, яка виступає в окисно-відновних реакціях лише як окисник
A SO2
Б H2S
В S
Г H2SO4(конц.)
4.35 Укажіть кількість електронів, які приймає окисник в окисно-відновній реакції, схема якої: 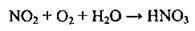
А 2
Б 3
В 4
Г 5
4.36 Укажіть рівняння окисно-відновної реакції

4.37 Укажіть, скільки теплоти виділиться чи поглинеться, якщо 0,25 моль ферум(ІІІ) оксиду прореагує з алюмінієм згідно з термохімічним рівнянням реакції:
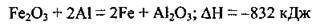
А виділиться 416 кДж теплоти
Б поглинеться 416 кДж теплоти
В виділиться 208 кДж теплоти
Г поглинеться 208 кДж теплоти
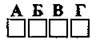
4.38 У реакції, що описують рівнянням: 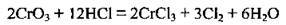
А Хром окислюється
Б Оксиген відновлюється
В Хлор окислюється
Г Гідроген відновлюється
4.39 Укажіть речовину, яка виступає в окисно-відновних реакціях лише як окисник
A N2
Б NO
В KNО2
Г KNО3
4.40 Якщо атом Хлору зі ступенем окиснення +5 приймає шість електронів, то електронне рівняння цього процесу буде
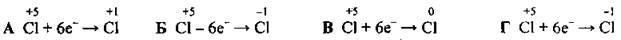
4.41 У складі якої речовини Бром може бути лише відновником?
А Вr2
Б КВrO3
В НВr
Г КВrO
4.42 Установіть послідовність зменшення ступеня окиснення Нітрогену в сполуках, формули яких наведено
A KNO2
Б Ca3N2
В Ca(NO3)2
Г N2
4.43 Укажіть речовину, яка виступає в окисно-відновних реакціях і як окисник, і як відновник
А МnO2
Б МnСl2
В КМnO4
Г Ва(МnO4)2
4.44 Хімічні реакції, які відбуваються з виділенням теплоти, називають
А каталітичними
Б ендотермічними
В екзотермічними
Г окисно-відновними
4.45 Установіть відповідність між хімічною реакцією та її типом
Реакція: | Тип реакції: |
| А розклад |
Б заміщення | |
В гідроліз | |
Г сполучення | |
Д обмін |
4.46 Укажіть рівняння реакції, яка є окисно-відновною
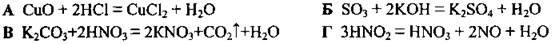
4.47 Установіть послідовність зменшення ступеня окиснення Мангану в сполуках, формули яких наведено
А МnО
Б КМnO4
В МnO2
Г К2МnO4

4.48 Укажіть речовини зі ступенем окиснення неметалічного елемента +3: 1) SO3; 2) Аl2O3; 3) В2O3; 4) Fe2O3; 5) P2S3; 6) N2O3
А 3, 4, 5
Б 3, 5, 6
В 4, 5, 6
Г 2, 3, 4
4.49 Укажіть оборотну реакцію
А горіння ацетилену
Б окиснення сульфур(ІV) оксиду киснем
В калій оксид з водою
Г кальцій карбонат з нітратною кислотою
4.50 Укажіть рівняння каталітичної реакції

4.51 Укажіть каталізатор реакції розкладу гідроген пероксиду
А цинк
Б хром(ІII) оксид
В вода
Г манган(ІV) оксид
4.52 Укажіть хімічний елемент, що є відновником у хімічній реакції між алюмінієм і сульфатною кислотою
А Гідроген
Б Сульфур
В Алюміній
Г Оксиген
4.53 Укажіть формули речовин, що містять металічний елемент зі ступенем окиснення +1: 1) Сl2O; 2) Сu2O; 3) МnО; 4) Cs2O; 5) Сr2O3; 6) МnO2
А 2, 3
Б 3, 4
В 4, 6
Г 2, 4
4.54 За електронною будовою атома визначте мінімальний і максимальний ступені окиснення елемента…4s24p3
А +3 і -3
Б +4 і -4
В -3 і +5
Г -1 і +6
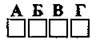
4.55 Укажіть схему процесу відновлення

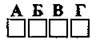
4.56 Розташуйте елементи, електронні формули яких наведено, в послідовності зменшення їхніх окисних властивостей
A…4s24р2
Б…4s24р4
В…4s24p5
Г…4s24p3

4.57 Укажіть речовину, у реакції з якою водень є окисником
А кисень
Б хром(ІІІ) оксид
В сірка
Г барій
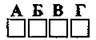
4.58 Укажіть пару речовин зі ступенем окиснення неметалічного елемента +3
А В2O3, Р2O3
Б СrO3, N2O3
В Сr2O3, Аl2o3
Г К2О4, СO2
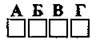
4.59 Найсильнішим окисником із р-елементів 4-го періоду є
А Хлор
Б Бром
В Криптон
Г Манган
4.60 Визначте ступені окиснення Нітрогену в амоній нітриті
А -3, +3
Б -4, +5
В -3, +5
Г -4, +3
4.61 Укажіть назву речовини, у реакції з якою Фосфор є відновником
А кальцій
Б калій
В хлор
Г цинк
4.62 Укажіть напівсхему реакції, у якій фосфор є окисником
А Р + O2 →
Б P + S →
В Р + Сl2 →
Г К + Р →
4.63 Укажіть чинники, які сприятимуть зміщенню рівноваги реакції: 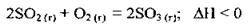 у бік вихідних речовин: 1) підвищення температури; 2) зниження температури; 3) підвищення тиску; 4) зниження тиску; 5) підвищення концентрації сульфур(ІV) оксиду; 6) підвищення концентрації сульфур(VІ) оксиду
у бік вихідних речовин: 1) підвищення температури; 2) зниження температури; 3) підвищення тиску; 4) зниження тиску; 5) підвищення концентрації сульфур(ІV) оксиду; 6) підвищення концентрації сульфур(VІ) оксиду
А 1, 3, 5
Б 2, 3, 4
В 1, 4, 6
Г 2, 4, 5
4.64 Як потрібно змінити концентрацію водню в його реакції з азотом, щоб змістити хімічну рівновагу в бік утворення продукту реакції?
А підвищити
Б знизити
В спочатку підвищити, а потім знизити
Г спочатку знизити, а потім підвищити