Узагальнення й систематизація знань про неметали, їх оксиди, гідрати. Розв’язання задач
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 15
Тема уроку. Узагальнення й систематизація знань про неметали, їх оксиди, гідрати. Розв’язання задач
Цілі уроку: узагальнити й систематизувати знання учнів про неметали, їх оксиди, гідриди, гідрати; удосконалювати знання, уміння й навички учнів складати реакції іонного обміну, окисно-відновні реакції, розв’язувати задачі на вихід продукту реакції, надлишок і нестачу.
Тип уроку: узагальнення й систематизації знань, умінь і навичок і творчого застосування
Форми роботи: навчальний семінар.
Обладнання: періодична таблиця хімічних елементів, таблиця розчинності, ряд активності металів, картки-завдання.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання
III. Семінар
1. Завдання для фронтальної роботи
Завдання 1. Складіть рівняння реакцій відповідно до схеми (схему зображено на дошці або в картках-завданнях, учні виконують завдання по черзі біля дошки).
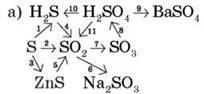
Для реакцій 4, 5, 10, 11 – скласти ОВР, реакції 6, 7, 8, 9 написати в іонно-молекулярній формі.
Б) NO2  HNO3
HNO3 
 NH3
NH3  (NH4)2SO4
(NH4)2SO4Завдання 2. Допишіть рівняння практично здійсненних реакцій (двоє учнів біля дошки, решта – за варіантами в зошитах).
Варіант І

Варіант ІІ

Завдання 3. Дано рівняння реакції:
2NO + O2 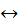 2NO2 + Q
2NO2 + Q
Укажіть умови, що вплинуть на зміщення рівноваги реакції (обговорюємо в класі):
А) охолодження;
Б) зниження тиску;
В) нагрівання;
Г) збільшення концентрації кисню.
Відповідь обгрунтуйте.
Завдання 4. Дано рівняння реакції:
N2 + O2 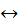 2NO – Q
2NO – Q
З перелічених умов виберіть ті, що вплинуть на зміщення рівноваги реакції ліворуч (учні виконують самостійно з наступним обговоренням у класі):
А) збільшення концентрації азоту;
Б) охолодження;
В) збільшення концентрації нітроген(ІІ) оксиду;
Г) нагрівання.
Відповідь обгрунтуйте.
Завдання 5. Обчисліть масу солі, що утворилася, якщо в реакцію вступило 34 г ферум(ІІІ) оксиду й 19,6 г сульфатної кислоти.
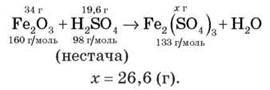
2. Завдання для групової роботи
Учні об’єднуються в шість-вісім груп, завдання в групах повторюються з метою взаємоперевірки.
Група 1
1. Обчисліть об’єм карбон(IV) оксиду за н. у., що виділиться в результаті взаємодії 5,3 г натрій карбонату й 8 г сульфатної кислоти.
2. З перелічених речовин виберіть ті, з якими реагуватиме розчин сульфатної кислоти: натрій гідроксид, купрум(ІІ) оксид, золото, магній, барій хлорид, срібло, алюміній гідроксид. Наведіть рівняння реакцій у молекулярній, повній та скороченій іонній формах.
3. До 540 г розчину купрум(ІІ) хлориду долили 560 г розчину натрій гідроксиду з масовою часткою лугу 20 %. Обчисліть масу осаду, що випав, якщо масова частка купрум(ІІ) хлориду становить 20 %.
4. У процесі нагрівання амоній нітриту утворилися азот і вода. Обчисліть об’єм азоту (н. у.), який можна одержати в результаті розкладання 128 г амоній нітриту, якщо об’ємна частка виходу азоту становить 90 %.
Група 2
1. Обчисліть масу натрій сульфату, що утвориться в результаті зливання двох розчинів, які містять 16 г натрій гідроксиду й 10 г сульфатної кислоти.
2. З перелічених речовин виберіть ті, з якими реагуватиме розчин сульфатної кислоти: кальцій гідроксид, мідь, цинк хлорид, залізо, силіцій(IV) оксид, барій нітрат, купрум(ІІ) гідроксид. Наведіть рівняння реакцій у молекулярній, повній та скороченій іонній формах.
3. Змішали 300 г розчину натрій гідроксиду та 250 г розчину хлоридної кислоти. Обчисліть масу води, що утворилася, якщо до зливання розчини мали однакову масову частку розчиненої речовини – 36 %.
4. У процесі нагрівання 42 г амоній хлориду з надлишком кальцій гідроксиду одержали амоніак об’ємом 11,6 л (н. у.). Обчисліть об’ємну частку виходу амоніаку.
Група 3
1. Обчисліть масу фосфатної кислоти, яку можна одержати з 200 кг фосфориту, що містить 60 % кальцій фосфату, дією на нього сульфатної кислоти, якщо масова частка виходу кислоти становить 80 %.
2. З перелічених речовин виберіть ті, з якими реагуватиме розчин сульфатної кислоти: літій гідроксид, алюміній, барій хлорид, сульфур(IV) оксид, ферум(ІІІ) оксид, мідь, цинк гідроксид. Наведіть рівняння реакцій у молекулярній, повній та скороченій іонній формах.
3. Обчисліть масу осаду, що утвориться в результаті зливання 257 г розчину аргентум нітрату з масовою часткою солі 3,4 % і 364 г розчину хлоридної кислоти з масовою часткою кислоти 2,92 %.
4. У процесі розкладання амоній хлориду масою 107 г одержали амоніак об’ємом 38 л (н. у.). Обчисліть об’ємну частку виходу амоніаку.
Група 4
1. Обчисліть масу міді, потрібну для реакції з надлишком концентрованої нітратної кислоти для одержання 4 л (н. у.) нітроген(IV) оксиду, якщо об’ємна частка виходу нітроген(IV) оксиду становить 96 %.
2. З перелічених речовин виберіть ті, з якими реагуватиме розчин сульфатної кислоти: ртуть, ферум(III) гідроксид, барій нітрат, калій гідроксид, магній оксид, цинк, карбон(IV) оксид. Наведіть рівняння реакцій у молекулярній, повній та скороченій іонній формах.
3. Обчисліть масу осаду, що утвориться в результаті зливання 257 г розчину аргентум нітрату з масовою часткою солі 3,4 % і 364 г розчину хлоридної кислоти з масовою часткою кислоти 2,92 %.
4. Обчисліть об’єм амоніаку (н. у.), який можна одержати, нагріваючи 75 г амоній сульфату з надлишком кальцій гідроксиду, прийнявши, що об’ємна частка виходу амоніаку становить 96 %.
IV. Підбиття підсумків уроку
Обговорення підсумків уроку, оцінювання роботи учнів на уроці.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Підготуватися до контрольної роботи.