Хімічні властивості бензену: повне й часткове окиснення, приєднання, заміщення. Одержання й використання бензену
І СЕМЕСТР
Тема 2. ВУГЛЕВОДНІ
Урок 17
Тема уроку. Хімічні властивості бензену: повне й часткове окиснення, приєднання, заміщення. Одержання й використання бензену
Цілі уроку: формувати в учнів знання про хімічні властивості бензену та його похідних, про реакції приєднання й заміщення в бензольному кільці; розвивати вміння складати хімічні рівняння на прикладі властивостей бензену; ознайомити учнів з головними способами одержання бензену, використанням бензену та його похідних.
Тип уроку: вивчення нового матеріалу.
Форми
Демонстрація 9. Взаємодія бензену з розчином калій перманганату.
Демонстрація 10. Горіння бензену.
Демонстрація 11. Взаємодія бензену з бромною водою.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань.
Мотивація навчальної діяльності
1. Відповіді учнів біля дошки
¦ Поясніть механізм утворення хімічного зв’язку в бензольному кільці.
¦ Які фізичні властивості мають бензен та його гомологи?
¦ На підставі знань про ненасичені вуглеводні передбачте, які хімічні властивості проявлятимуть бензен
¦ Поясніть, як впливатиме на властивості аренів наявність бензольного кільця.
2. Демонстрація 10. Горіння бензену
¦ Запишіть рівняння горіння бензену:
C6H6 + 7,5O2 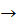 6CO2 + 3H2O + Q (кіптяве полум’я)
6CO2 + 3H2O + Q (кіптяве полум’я)
¦ Чому полум’я кіптяве?
III. Вивчення нового матеріалу
ХІМІЧНІ ВЛАСТИВОСТІ АРЕНІВ
Бензольне ядро має високу міцність, чим і пояснюється схильність ароматичних вуглеводнів до реакцій заміщення. На відміну від алканів, які також схильні до реакцій заміщення, ароматичні вуглеводні характеризуються більшою рухливістю атомів Гідрогену в ядрі, тому реакції галогенування, нітрування, сульфірування та інші відбуваються у значно більш м’яких умовах, ніж в алканів.
Електрофільне заміщення в бензені
Незважаючи на те що бензен за складом є ненасиченою сполукою, для нього не характерні реакції приєднання. Типовими реакціями бензольного кільця є реакції заміщення атомів Гідрогену – реакції електрофільного заміщення.
Розглянемо приклади найбільш характерних реакцій цього типу.
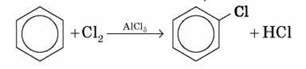
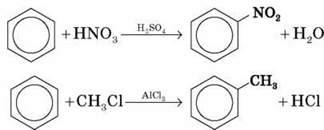
Галогенування
Під час узаємодії бензену з галогеном (у цьому випадку – з хлором) атом Гідрогену ядра заміщається галогеном:
Реакції галогенування здійснюються в присутності каталізатора; як такий найчастіше використовують хлориди Алюмінію або Феруму.
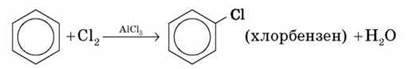
Нітрування
У разі дії на бензен нітрувальної суміші атом Гідрогену заміщається нітрогрупою (нітрувальна суміш – це суміш концентрованих нітратної та сульфатної кислот у співвідношенні 1:2 відповідно).
Сульфатна кислота в цій реакції відіграє роль каталізатора й засобу, що відщеплює воду.
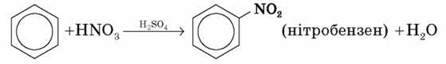
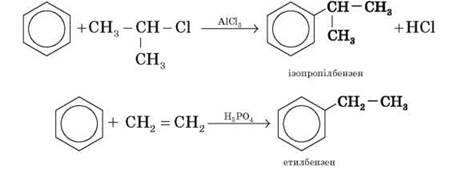
Алкілування (реакція Фріделя – Крафтса)
У процесі дії на бензен алкілгалогенідів у присутності каталізатора (алюміній хлориду) відбувається заміщення алкілом атома Гідрогену бензольного ядра.
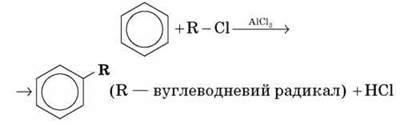
Слід відзначити, що реакція алкілування є загальним способом одержання гомологів бензену – алкілбензенів.
Незважаючи на схильність бензену до реакцій заміщення, він у жорстких умовах вступає також у реакції приєднання.
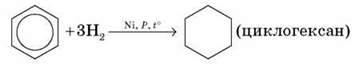
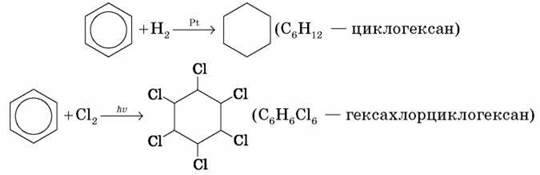
Гідрування
Приєднання водню здійснюється виключно в присутності каталізаторів і за підвищеної температури. Бензен гідрується з утворенням циклогексану, а похідні бензену дають похідні циклогексану.
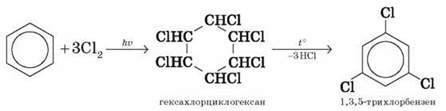
На сонячному світлі під впливом ультрафіолетового випромінювання бензен приєднує хлор і бром з утворенням гексагалогенідів, які внаслідок нагрівання втрачають три молекули галогеноводню й утворюють тригалогенбензени.
Демонстрація 11. Взаємодія бензену з бромною водою
Завдання. Запишіть рівняння бромування бензену.
Окиснення
Бензольне ядро є більш стійким до окиснення, ніж алкани. Навіть калій перманганат, нітратна кислота, гідроген пероксид за звичайних умов на бензен не діють. У разі ж дії окисників на гомологи бензену найближчий до ядра атом Карбону бічного ланцюга окислюється до карбоксильної групи й утворює ароматичну кислоту.
Демонстрація 9. Взаємодія бензену з розчином калій перманганату
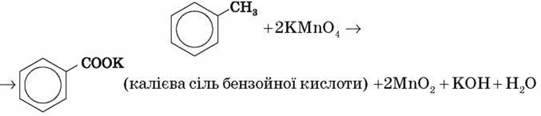
За наявності в бензольному кільці кількох замісників можна окислити послідовно всі наявні ланцюги. Ця реакція застосовується для визначення будови ароматичних вуглеводнів.
Застосування
Ароматичні вуглеводні є важливою сировиною для виробництва різних синтетичних матеріалів, барвників, фізіологічно активних речовин. Так, бензен є продуктом для одержання барвників, медикаментів, засобів захисту рослин та ін. Толуен використовується як сировина у виробництві вибухових речовин, фармацевтичних препаратів, а також як розчинник. Вінілбензен (стирол) застосовується для одержання полімерного матеріалу – полістиролу.
IV. Первинне застосування одержаних знань
1. Узагальнення отриманих відомостей про хімічні властивості бензену
А) Заміщення атомів Гідрогену в бензольному кільці
(відбувається легше, ніж в алканів)
Б) Приєднання (відбувається важче, ніж в алкенів)
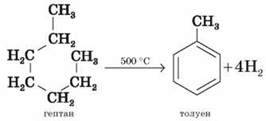
2. Одержання
Запропонуйте можливі способи одержання аренів з огляду на хімічні властивості вивчених вуглеводнів.
(Учитель коментує запропоновані учнями способи, пояснює нові.)
1) Каталітична дегідроциклізація алканів, тобто відщеплення водню з одночасною циклізацією (спосіб Б. О. Казанського й А. Ф. Плате). Реакція здійснюється за підвищеної температури з використанням каталізатора, наприклад хром оксиду.
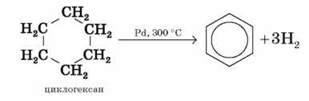
2) Каталітичне дегідрування циклогексану та його похідних (М. Д. Зелінський). Як каталізатор використовується паладієва чернь або платина за температури 300 °С.
3) Циклічна тримеризація ацетилену та його гомологів над активованим вугіллям за температури 600 °С (М. Д. Зелінський).
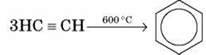
*Сплавлення солей ароматичних кислот з лугом або натронним вапном.
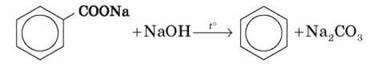
4) *Алкілування власне бензену галогенопохідними (реакція Фріделя – Крафтса) або олефінами.
V. Підбиття підсумків уроку
Оцінювання роботи учнів на уроці.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.