Хімічні властивості спиртів – СПИРТИ Й ФЕНОЛИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ОРГАНІЧНА ХІМІЯ
СПИРТИ Й ФЕНОЛИ
Хімічні властивості спиртів
1. Горіння. При збільшенні кількості атомів Карбону в молекулі спиртів поряд з реакцією повного згорання спиртів може відбуватися реакція неповного згорання з виділенням сажі (вуглецю), що призводить до збільшення світління полум’я. Виділення різних продуктів (СO2 та С) пояснює явище яскравого полум’я, що коптить.
Повне згорання (достатня кількість кисню):
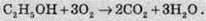
Неповне згорання з виділенням чадного газу (нестача кисню):
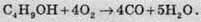
Неповне згорання з виділенням сажі (нестача кисню):
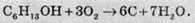
2. Взаємодія спиртів з лужними металами. Атоми активних металів витісняють атоми Гідрогену гідроксильної групи з утворенням алкоголятів та газоподібного водню:
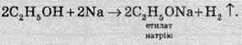
Реакція з натрієм дає привід зараховувати спирти до класу кислот. Однак спирт не проводить електричного струму, не забарвлює лакмус в червоний колір, майже не взаємодіє з водними розчинами лугів, його дисоціація виражена значно слабше, ніж
Багатоатомні спирти також здатні взаємодіяти з активними металами, зокрема з натрієм. Реакція відбувається аналогічно до одноатомних спиртів.
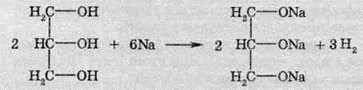
Взаємодія з натрієм відбувається дуже бурхливо з виділенням великої кількості теплоти, унаслідок чого водень, який виділяється, може самозайматися.
3. Взаємодія спиртів з галогеноводнями. Спирти здатні взаємодіяти з галогеноводнями в присутності концентрованої сульфатної кислоти з утворенням галогеналканів (гідроксильна група заміщається атомом галогену):
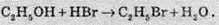
Багатоатомні спирти взаємодіють із галогеноводнями в присутності речовин, які зв’язують воду. Однак відгін з реакційного середовища галогенопохідних багатоатомних спиртів утруднений унаслідок високої температури кипіння:
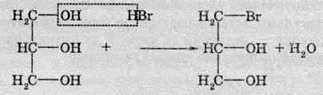
Заміщення другої гідроксильної групи більш утруднене, а третя гідроксильна група, як правило, не заміщається.
4. Дегідратація. Процес дегідратації може відбуватися двома різними способами: за участю однієї молекули спирту та двох молекул спирту.
4.1. Внутрішньомолекулярна дегідратація. Під дією водовідіймального засобу (найчастіше в цій ролі виступає сульфатна кислота) від молекули спирту відщеплюється молекула води: гідроксильна група й атом Гідрогену від сусіднього атома Карбону. При цьому вільні валентності двох сусідніх атомів Карбону насичуються за рахунок утворення додаткового зв’язку: у процесі внутрішньомолекулярної дегідратації спиртів утворюються ненасичені вуглеводні:
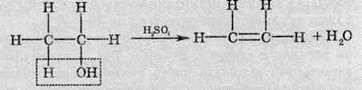
Реакція дегідратації є оборотною реакцією. Здійснюючи її у зворотному напрямку, тобто приєднуючи воду до ненасичених вуглеводнів, добувають спирти.
4.2. Міжмолекулярна дегідратація. При надлишку етанолу й не дуже сильному нагріванні реакція дегідратації може протікати за участю двох молекул – міжмолекулярна дегідратація. При цьому утворюються прості етери:
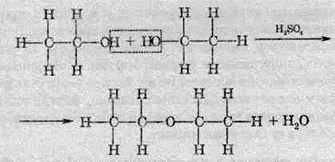
5. Взаємодія багатоатомних спиртів з мінеральними кислотами.
Багатоатомні спирти здатні взаємодіяти з мінеральними кислотами (наприклад, з нітратною) з утворенням етерів. Ця реакція лежить в основі виробництва вибухових речовин:
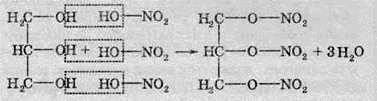
Взаємодією з нітратною кислотою добувають динітроетиленгліколь і тринітрогліцерол.
6. Якісна реакція на багатоатомні спирти. Якісною реакцією на багатоатомні спирти є взаємодія їх зі свіжоосадженим купрум(ІІ) гідроксидом. Атоми Купруму заміщають атоми Гідрогену в гідроксигрупі аналогічно до взаємодії з натрієм. У результаті реакції при додаванні до блакитного осаду купрум(ІІ) гідроксиду розчину багатоатомного спирту утворюється темно-синій розчин комплексної сполуки Купруму із двома молекулами спирту:
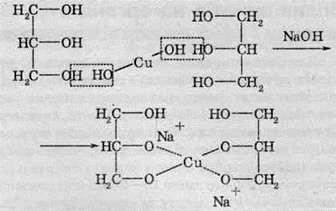
Аналогічно купрум(ІІ) гідроксид реагує й з іншими багатоатомними спиртами.