Хімічні властивості спиртів. Використання спиртів. Отруйність спиртів, їх шкідливий вплив на організм людини
Тема 3
НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ
Урок 45
Тема уроку. Хімічні властивості спиртів. Використання спиртів. Отруйність спиртів, їх шкідливий вплив на організм людини
Цілі уроку: вивчити хімічні властивості спиртів на прикладі метанолу, етанолу й гліцерину (реакції повного окиснення, взаємодії з металевим натрієм); показати зв’язок хімічних властивостей спиртів з наявністю функціональної гідроксильної групи; формувати знання учнів про використання спиртів; показати їх отруйність, довести шкідливий вплив метанолу й етанолу
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: розповідь учителя, міні-конференція, демонстраційний експеримент, лабораторний експеримент.
Демонстрація 14. Взаємодія етанолу з натрієм.
Демонстрація 15. Взаємодія гліцерину з натрієм.
Лабораторний дослід 8. Досліди з гліцерином: розчинність у воді, взаємодія з купрум(ІІ) гідроксидом.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання. Мотивація навчальної діяльності
Учні повторюють біля дошки особливості будови спиртів, зумовлені
1) Чи відрізнятимуться властивості спиртів і вуглеводнів? Чому?
2) Яка група атомів визначає властивості спиртів: вуглеводневий радикал чи гідроксильна група?
III. Вивчення нового матеріалу
Хімічні властивості спиртів
1. Вступне слово вчителя
Спирти – нейтральні речовини, незважаючи на наявність гідроксильної групи, спирти не змінюють забарвлення індикаторів, не вступають у хімічні реакції з водними розчинами лугів і розведених кислот. Лабораторні спиртівки заповнюють 98%-м спиртом. Який висновок можна зробити про горючість спиртів?
2. Хімічні властивості спиртів. Окиснення, взаємодія з натрієм
1) Повне окиснення (горіння)
C2H5OH + 3,5O2  2CO2 + 3H2O + Q
2CO2 + 3H2O + Q
Аналогічно учні записують рівняння горіння для метанолу та гліцерину.
2) Зсув електронної густини в молекулі спирту спричиняє рухливість атома Гідрогену в гідроксильній групі, тому цей атом Гідрогену може заміщатися металевим натрієм.
Демонстрація 14. Взаємодія 96%-го спирту з металевим натрієм
Що спостерігаємо? Виділення бульбашок водню. Ця реакція протікає менш активно, ніж у воді:
2C2H5OH + 2Na  2C2H5OH + H2
2C2H5OH + H2
Аналогічно учні самостійно записують рівняння взаємодії метанолу з металевим натрієм.
Демонстрація 15. Взаємодія гліцерину з натрієм
Візьмемо безводний гліцерин, акуратно додамо шматочок металевого натрію.
Чи відбуватиметься хімічна реакція? За якими ознаками можна судити про протікання хімічної реакції? У молекулі гліцерину містяться три гідроксильні групи, які взаємодіють із натрієм (одна, дві або всі три залежно від кількісного співвідношення реагентів).
Завдання 1. Запишіть рівняння взаємодії гліцерину з металевим натрієм у співвідношенні 1:1, 1:2, 1:3.
3. Хімічні властивості спиртів: дегідратація
Наявність гідроксильної групи визначає хімічні властивості спиртів, зокрема їх взаємодію з галогеноводнями.
Учні аналогічно записують реакцію метанолу із бромоводнем.
Важливе практичне значення має реакція дегідратації спиртів.
Дегідратація – відщеплення води, відбувається під дією концентрованої сульфатної кислоти.
За температури понад 140 °С протікає внутрішньо-молекулярна дегідратація з утворенням подвійного зв’язку:
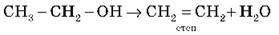
За температури менш ніж 140 °С протікає міжмолекулярна дегідратація з утворенням етерів:
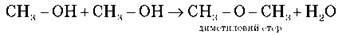
Завдання 2. Запишіть рівняння реакції одержання діетилового етеру.
IV. Первинне застосування отриманих знань
Лабораторний дослід 8. Досліди із гліцерином
1) У хімічну склянку з 1 мл гліцерину порціями по 1 мл, перемішуючи, додамо 10 мл води. Що спостерігаємо?
Висновок: гліцерин добре розчиняється у воді.
2) Приготуємо в пробірці купрум(ІІ) гідроксид, додамо до нього розчин гліцерину й перемішаємо. Що спостерігаємо? Осад розчинився, розчин набув яскраво-синього кольору.
Висновок: дія купрум(ІІ) гідроксиду – якісна реакція на багатоатомні спирти.
3) Зобразіть структурні формули 1-бутанолу, 2-метил-1-пропанолу.
4) Напишіть реакцію внутрішньо-молекулярної дегідратації 1-пропанолу.
5) Обчисліть масу етанолу, що повністю прореагувала з B моль металевого натрію.
V. Міні-конференція “Застосування спиртів. Шкідливий вплив метанолу й етанолу на організм людини”
1. Повідомлення учнів про отруйність спиртів
2. Розгляд схем застосування спиртів, що грунтується на їх фізичних і хімічних властивостях
3. Застосування етанолу
У медицині як дезінфікуючий засіб, як сировина хімічного синтезу, у фармацевтичній хімії, як розчинник та ін.
4. Застосування гліцерину
Як зволожувальний засіб для виготовлення фармацевтичних препаратів і парфумерних засобів, як сировина хімічних виробництв, у харчовій промисловості, для одержання динаміту, гліфталевих смол.
VI. Підбиття підсумків уроку
Завершальне слово вчителя
Метанол і етанол – отруйні речовини, на цьому базується їх використання як дезінфікуючих засобів.
Метанол (метиловий спирт) – сильна й небезпечна для людини отрута, що проникає в організм під час вдихання повітря, насиченого його парами, і навіть крізь шкіру. Якщо його концентрація перевищує B г на 1 м3, потрапляючи в організм, метанол сильно вражає нервову й судинну системи. Особливо активно він впливає на зоровий нерв і сітчасту оболонку ока, що може призвести до необоротної сліпоти. Метиловий спирт порушує окисні процеси й кислотно-лужну рівновагу в клітинах і тканинах. У результаті цього настає ацидоз. Крім того, метанол має кумулятивні властивості, тобто його продукт накопичується в організмі, створюючи смертельно небезпечну концентрацію. Отруєння метиловим спиртом у деяких випадках закінчується смертю. Найбільш легка форма отруєння характеризується наявністю головного болю, загальною слабкістю, нездужанням, ознобом, нудотою, блювотою. От чому небезпечний для життя не лише метанол, але й рідини, що містять цю отруту навіть у порівняно невеликій кількості.
Етанол – речовина наркотичного типу, що пригнічує центральну нервову систему. Вплив алкоголю на поводження залежить від кількості спирту, що досяг через кров мозку. Цей “рівень алкоголю в крові” визначається ще кількома факторами, крім кількості випитого. Розмір печінки визначає швидкість окиснення й виведення алкоголю. Маса людини визначає кількість крові в організмі, оскільки об’єм крові пропорційний їй. Чим більша людина, тим сильніше кров розбавляє вжитий алкоголь і тим більше його потрібно, щоб створити той самий ефект. Важливі також швидкість і манера вживання алкоголю. Чим повільніше людина п’є певну кількість алкоголю, тим слабший його вплив. Уживання алкоголю натщесерце має сильніший і швидший ефект, ніж уживання під час або після їжі. їжа діє як буфер під час поглинання спирту. В організмі спирт окислюється до вуглекислого газу й води. При цьому вивільняється велика кількість енергії – 29,8 кДж/год. А за 1 год. в печінці окислюється близько 10 мл спирту. Уведення спирту в організм порушує його теплоізоляцію внаслідок розширення шкірних кровоносних судин. Суб’єктивне відчуття тепла, пов’язане з цим явищем, насправді не супроводжується підвищенням температури тіла. Навпаки, організм утрачає теплоту, тому вживання спирту на холоді пов’язано з ризиком замерзти. Посилюючи активність слинних і шлункових залоз, спирт призводить до посиленого виділення хлоридної кислоти та пригнічує травні ферменти. Уживання спиртних напоїв призводить до отруєння організму. За концентрації спирту в крові 1-2 г/л настає сп’яніння, за 3-4 г/л розвивається загальна інтоксикація організму, за 5-8 г/л настає смерть.
Оцінювання роботи учнів на уроці
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.