Загальна характеристика – Урок 4 – Елементи VA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.4. Елементи VA групи
9.4.1. Загальна характеристика
До складу головної підгрупи V групи1 входять Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Вісмут Ві.
Будова зовнішнього електронного шару елементів – ns’2np3. Це p-елементи:
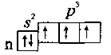
Валентність Нітрогену – III, а в решти елементів – III і V. Як в елемента 2-го періоду, в атома Нітрогену немає d-підрівня, тому
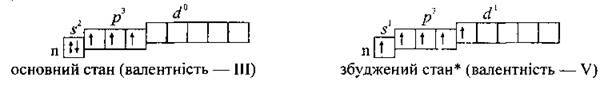
Атом Нітрогену, крім трьох ковалентних зв’язків, може утворювати ще один зв’язок за донорно-акцепторний механізмом, тобто надавати свою неподілену пару електронів на вільну орбіталь атома іншого елемента. Таким чином, максимальна валентність Нітрогену – IV.
У сполуках елементи групи Нітрогену, крім Стибію і Вісмуту, можуть виявляти найнижчий ступінь окиснення (-3). Усі
У групі від Нітрогену до Вісмуту зростає радіус атома, послаблюється притягання валентних електронів до ядра, а тому зменшується електронегативність, неметалічні властивості елементів і збільшуються металічні. Бісмут уже належить до металічних елементів.
Загальна формула гідрогеновмісних сполук – ЕН3. Це аміак (амоніак) NH3, фосфін РН3, арсин AsH3, стибін SbH3, вісмутин ВіН3. Ступінь окиснення Нітрогену в цих сполуках – -3, тому для них характерні відновні властивості.
Загальні формули оксидів елементів групи – Е2О3 і E2O5. Вони мають кислотний характер, тому їм відповідають кислоти Н3ЕО3 і Н3ЕО4. Кислотні властивості оксидів у ряду N2О5 – Р2О5 – As2О5 – Sb2О5 – Ві2О5 послаблюються.
______________________________________________________________
1 За новою номенклатурою – 15 групи.
Related posts:
- Загальна характеристика – Урок 3 – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.1. Загальна характеристика До складу головної підгрупи VI групи1 належать Оксиген, Сульфур, Селен, Телур і Полоній. Елементи цієї підгрупи ще називають халькогенами2, або елементами підгрупи Оксигену. Це p-елементи; будова зовнішнього електронного рівня […]...
- Загальна характеристика – Урок 5 – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.1. Загальна характеристика До складу головної підгрупи IV групи (14 групи) входять Карбон (С), Силіцій (Si), Германій (Ge), Станум (Sn) і Плюмбум (Рb). Будова зовнішнього електронного шару елементів – ns2nр2. Це p-елементи: […]...
- Загальна характеристика – Урок 2 – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.1. Загальна характеристика Лужноземельні металічні елементи – це s-елементи, які розміщуються у головній підгрупі II групи періодичної системи, а саме: Кальцій (Са), Стронцій (Sr), Барій (Ва), Радій (Ra). Інші […]...
- Загальна характеристика – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.1. Загальна характеристика Лужні металічні елементи – це s-елементи, які розміщуються у головній підгрупі І групи періодичної системи: Літій (Li), Натрій (Na), Калій (К), Рубідій (Rb), Цезій (Cs) та Францій […]...
- Загальна характеристика підгрупи нітрогену – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.1. Загальна характеристика підгрупи нітрогену Підгрупу нітрогену складають п’ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів – ns2 […]...
- Загальна характеристика підгрупи бору – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.10. Загальна характеристика підгрупи бору Головну підгрупу III групи (підгрупу бору) складають елементи бор, алюміній, галій, індій і талій. Деякі властивості цих елементів наведено у табл. 13.3. Таблиця 13.3. Властивості елементів підгрупи бору Властивості В АІ […]...
- Загальна характеристика підгрупи берилію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.5. Загальна характеристика підгрупи берилію Цю підгрупу складають берилій, магній і лужноземельні елементи (кальцій, стронцій, барій, радій). Деякі властивості цих елементів наведено в табл. 13.2. Таблиця 13.2. Властивості елементів підгрупи берилію Властивості Be Mg Са Sr […]...
- Загальна характеристика підгрупи оксигену – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.1. Загальна характеристика підгрупи оксигену До підгрупи оксигену входять п’ять елементів: оксиген, сульфур, селен, телур і полоній (полоній – радіоактивний елемент). Це р-елементи VI групи періодичної системи Д. І. Менделєєва. Вони мають групову назву – халькогени, що […]...
- Загальна характеристика підгрупи літію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.1. Загальна характеристика підгрупи літію Підгрупу літію складають елементи: літій, натрій, калій, рубідій, цезій та францій. Деякі властивості цих елементів наведено в табл. 13.1. Це s-елементи (див. табл. 13.1, п. 2). Атоми на зовнішньому енергетичному рівні […]...
- Загальна характеристика підгрупи галогенів – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.5. Загальна характеристика підгрупи галогенів Під час розгляду хімії елементів за підгрупами винятково важливо вміти використовувати прогнозуючу роль періодичного закону і періодичної системи елементів Д. І. Менделєєва. Тоді багато властивостей елементів і їх сполук можна описати, не […]...
- Загальна характеристика підгрупи карбону – ПІДГРУПА КАРБОНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 11. ПІДГРУПА КАРБОНУ § 11.1. Загальна характеристика підгрупи карбону До підгрупи карбону належать карбон, силіцій, германій, станум і плюмбум. Це р-елементи IV групи періодичної системи Д. І. Менделєєва, їх атоми на зовнішньому рівні містять по чотири електрони – ns2np2 (п. 2, […]...
- Загальна характеристика хімічних елементів ІІА групи РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 61. Загальна характеристика хімічних елементів ІІА групи Усвідомлення змісту цього параграфа дає змогу: Характеризувати та порівнювати хімічні елементи ІІА групи за місцем у періодичній системі та електронною будовою атомів; поширеність у природі; Оцінювати їх біологічну роль. До ІІА групи періодичної системи […]...
- Сульфур – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.5. Сульфур Сульфур – 16-й елемент періодичної таблиці, заряд ядра – +16. Хімічний символ – S, відносна атомна маса – 32. Відомо чотири стабільні природні ізотопи: 32S, 33S, 34S і 36S. Електронегативність […]...
- Загальна характеристика хімічних елементів ІА групи РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 57. Загальна характеристика хімічних елементів ІА групи Усвідомлення змісту цього параграфа дає змогу: Характеризувати і порівнювати хімічні елементи ІА групи за місцем у періодичній системі та електронною будовою атомів; їх поширеність у природі; Оцінювати їх біологічну роль. До ІА групи належать […]...
- Оксиген – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.2. Оксиген Оксиген – 8-й елемент періодичної таблиці, заряд ядра – +8. Хімічний символ – О. Відомо три стабільні природні ізотопи Оксигену: 16O,17O, 18O, серед яких найчастіше трапляється 16О (99,76 %). Оксиген […]...
- Нітратна кислота – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.6. Нітратна кислота Нітратна кислота HNO3 – одна з найважливіших неорганічних кислот. Зв’язки між атомами в молекулі кислоти полярні ковалентні. Нітроген у нітратній кислоті виявляє свою максимальну валентність – IV, а ступінь […]...
- Аміак – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.3. Аміак Аміак (амоніак) – одна з найважливіших сполук Нітрогену. Молекула з чотирма гібридизованими sр3-орбіталями має форму майже правильного тетраедра, валентні кути (H-N-H) – 107,8°. У центрі розташований атом Нітрогену, вершину утворює […]...
- Загальна характеристика родини заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.5. Загальна характеристика родини заліза У побічній підгрупі VIII групи періодичної системи елементів Д. І. Менделєєва розташовано 9 елементів: ферум, кобальт, нікол, рутеній, родій, паладій, осмій, іридій, платина. Подібні між собою елементи цієї групи утворюють горизонтальні […]...
- Нітроген – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.2. Нітроген Нітроген – 7-й елемент періодичної таблиці, заряд ядра – +7. Хімічний символ – N. Відносна атомна маса – 14, молярна маса – 28 г/моль. Відомо два стабільні природні ізотопи Нітрогену: […]...
- Йонний зв’язок Хімія Загальна хімія Хімічний зв’язок Йонний зв’язок Йонний зв’язок – це зв’язок, зумовлений електростатичним тяжінням між різнойменно зарядженими йонами. Під час утворення йонного зв’язку один з атомів віддає електрон, перетворюючись на позитивно заряджений іон – катіоН, а інший приймає електрон, перетворюючись на негативно заряджений іон – аніоН. Різниця між електронегативностями атомів, які утворюють йонний зв’язок, […]...
- Характеристика хімічних елементів – НІТРОГЕН. ФОСФОР Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ НІТРОГЕН. ФОСФОР Характеристика хімічних елементів Властивості хімічних елементів Властивість Нітроген Фосфор Хімічний символ N Р Порядковий номер 7 15 Атомна маса 14,007 30,974 Місце в ПС 2 період; V група 3 період; V група Число електронів на енергетичних рівнях 2; 5 […]...
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- Загальна характеристика підгрупи хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.1. Загальна характеристика підгрупи хрому До металів побічних підгруп періодичної системи Д. І. Менделєєва належать всі d-елементи. Таких підгруп 10: скандію, титану, ванадію, хрому, мангану, феруму, кобальту, ніколу, купруму та цинку. Тут розглядаються загальні характеристики підгрупи […]...
- Валентність і ступінь окиснення РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 9. Валентність і ступінь окиснення Усвідомлення змісту цього параграфа дає змогу: Пояснювати сучасний зміст понять валентності та ступеня окиснення; Вміти визначати валентність і ступінь окиснення атомів елементів у сполуках та розмежовувати ці поняття. Поняття “валентність” було введено в хімію у середині ХІХ ст., […]...
- Загальна характеристика РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ До ІVА групи періодичної системи належать Карбон С, Силіцій Si, Германій Ge, Станум Sn і Плюмбум Pb. Карбон у вигляді сажі, кам’яного і деревного вугілля відомий з глибокої давнини. Назва Карбону походить від лат. carbo – вугілля. Й. Берцеліус (1779 – 1848) Д. І. […]...
- СТУПІНЬ ОКИСНЕННЯ ЕЛЕМЕНТА Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК СТУПІНЬ ОКИСНЕННЯ ЕЛЕМЕНТА Під ступенем окиснення розуміють позитивне або негативне число, що приписують елементу в сполуці. Ступінь окиснення елемента у простій речовині дорівнює нулю. У складній сполуці позитивний ступінь окиснення має менш електронегативний елемент; негативний ступінь окиснення проявляє більш електронегативний елемент. Алгебрична сума ступенів окиснення атомів у […]...
- Характеристика хімічних елементів – ОКСИГЕН. СУЛЬФУР Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ОКСИГЕН. СУЛЬФУР Характеристика хімічних елементів Властивості хімічних елементів Властивість Оксиген Сульфур Хімічний символ 0 S Порядковий номер 8 16 Атомна маса 15,9994 32,06 Місце в ПС 2 період; VI група 3 період; VI група Число електронів на енергетичних рівнях 2; 6 […]...
- Приклади розв’язування типових задач – Урок 4 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Приклади розв’язування типових задач Задача 1. Визначте ступені окиснення Фосфору в таких сполуках: К3Р, Na3PO4, К4Р2O7, Р2O5, Н3РO3. Розв’язання Задача 2. Визначте ступені окиснення Сульфуру в сполуках Na2SO3, Al2(SO4)3, Na2S2O3, SO2, SO3. Розв’язання Al2(SO4)3. Для встановлення ступеня окиснення Сульфуру можна […]...
- ОКСИДИ НІТРОГЕНУ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ОКСИДИ НІТРОГЕНУ Позитивну валентність Нітроген виявляє у сполуках з Оксигеном – оксидах. При цьому особливістю Нітрогену є те, що він утворює оксиди, які відповідають усім теоретично можливим валентностям від 1 до 5 (зовнішній енергетичний рівень атома Нітрогену містить п’ять електронів). Відповідно існують наступні оксиди нітрогену: N2O, NO, N2O3, […]...
- Кальцій – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.5. Кальцій Кальцій – 20-й елемент періодичної таблиці, заряд ядра – +20. Хімічний символ – Са. Відносна атомна маса – 40. Утворює просту речовину – сріблясто-білий метал кальцій. Виявляє […]...