Анілін, його склад, будова молекули, фізичні властивості. Хімічні властивості аніліну: взаємодія з неорганічними кислотами, бромною водою. Взаємний вплив атомів у молекулі аніліну. Одержання аніліну
II Семестр
Тема 5. НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Урок 51
Тема уроку. Анілін, його склад, будова молекули, фізичні властивості. Хімічні властивості аніліну: взаємодія з неорганічними кислотами, бромною водою.
Взаємний вплив атомів у молекулі аніліну. Одержання аніліну
Цілі уроку: ознайомити учнів з аніліном як представником нітросполук, його фізичними властивостями; дати уявлення про будову молекули аніліну; розглянути хімічні властивості аніліну, способи його одержання й застосування.
Тип уроку: комбінований урок
Форми роботи: розповідь учителя, евристична бесіда, лабораторна робота.
Демонстрація 1. Взаємодія аніліну з хлоридною кислотою.
Демонстрація 2. Взаємодія аніліну з бромною водою.
Обладнання: схема будови молекули аніліну.
ХІД УРОКУ
I. Оорганізація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
1. Чому аміни називають органічними основами?
Три учні біля дошки, решта – у зошитах виконують завдання.
2. Складіть рівняння реакцій взаємодії:
А) метиламіну із сульфатною кислотою;
Б)
В) метилетиламіну з хлоридною кислотою.
3. Одержте етиламін:
А) з відповідної нітросполуки;
Б) з відповідного спирту;
В) з етиламоній хлориду.
4. Як класифікуються аміни за типом вуглеводневого радикала?
III. Вивчення нового матеріалу
1. Історія відкриття аніліну
Анілін (феніламін) – органічна сполука з формулою C6H5NH2, найпростіший ароматичний амін. являє собою безбарвну маслянисту рідину з характерним запахом, трохи важчу за воду й погано в ній розчинну, добре розчиняється в органічних розчинниках. На повітрі анілін швидко окислюється й набуває червоно-бурого забарвлення. Отруйний.
Уперше анілін одержав у 1826 р. у процесі перегонки індиго з вапном німецький хімік, який дав йому назву “кристалін”. 1834 р. Ф. Рунге виявив анілін у кам’яновугільній смолі й назвав “кіанолом”. 1841 р. Ю. Ф. Фрішце одержав анілін у результаті нагрівання індиго з розчином КОН і назвав його “аніліном”. 1842 р. анілін одержав М. М. Зінін шляхом відновлення нітробензену (NH4)2SO3 і назвав його “бензидамом”. 1843 р. А. В. Гофман установив ідентичність усіх перелічених сполук. Слово “анілін” походить від назви однієї з рослин, що містять індиго, – Indigofera anil (сучасна міжнародна назва рослини – Indigofera suffruticosa).
Анілін – найпростіший ароматичний амін. Аміни є більш слабкими основами, ніж амоніак, оскільки неподілена електронна пара атома Нітрогену зміщається в бік бензольного кільця, сполучаючись із р-електронами бензольного ядра.
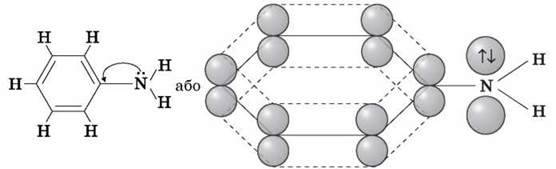
Зменшення електронної густини на атомі Нітрогену приводить до зниження здатності відщеплювати протони від слабких кислот. Тому анілін – слабша основа, ніж аліфатичні аміни й амоніак, взаємодіє лише із сильними кислотами (HCl, H2SO4), а його водний розчин не забарвлює лакмус у синій колір.
2. Одержання аніліну
¦ Запропонуйте способи одержання аніліну.
Відновлення нітросполук зазвичай використовують для одержання первинних амінів ароматичного ряду (реакція Зініна).
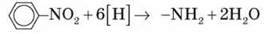
Атомарний водень утворюється в момент виділення в результаті реакції цинку (або алюмінію) з кислотою або лугом.
Спочатку анілін одержували шляхом відновлення нітробензену молекулярним воднем; практичний вихід аніліну не перевищував 15 %. 1842 р. професор Казанського університету М. М. Зінін розробив більш раціональний спосіб одержання аніліну відновленням нітробензену (реакція Зініна):
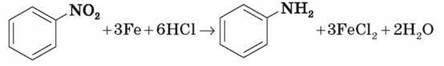
У процесі взаємодії концентрованої хлоридної кислоти із залізом виділяється атомарний водень, більш хімічно активний порівняно з молекулярним.
3. Хімічні властивості аніліну
Анілін – слабка основа. Із сильними кислотами анілін здатен утворювати солі.
Демонстрація 1. Взаємодія аніліну з хлоридною кислотою
Приготуємо суміш аніліну з водою. Додамо до суміші хлоридну кислоту. Відбувається розчинення аніліну. У розчині утворюється феніламоній хлорид, або солянокислий анілін.
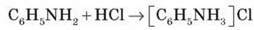
Завдання 1. Запишіть рівняння взаємодії аніліну із сульфатною кислотою.
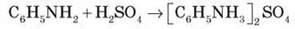
Аміногрупа впливає на бензольне кільце, спричиняючи збільшення рухливості атомів Гідрогену порівняно з бензеном, причому внаслідок сполучення неподіленої електронної пари з п-електронною ароматичною системою збільшується електронна густина в орто – й пара-положеннях.
У процесі нітрування та бромування анілін легко утворює 2,4,6-тризаміщені продукти реакції. Наприклад, анілін енергійно реагує з бромною водою з утворенням білого осаду 2,4,6-триброманіліну. Ця реакція використовується для якісного й кількісного визначення аніліну:
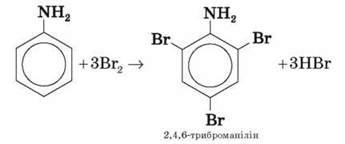
Демонстрація 2. Взаємодія аніліну з бромною водою Анілін легко окислюється. На повітрі анілін буріє, унаслідок дії інших окисників утворює речовини різноманітного забарвлення. З хлорним вапном CaOCl2 дає характерне фіолетове забарвлення. Це одна з найбільш чутливих якісних реакцій на анілін.
*Практичне значення має реакція аніліну з нітритною кислотою за зниженої температури (близько 0 °С). У результаті цієї реакції (реакції діазотування) утворюються солі діазонію, що використовуються в синтезі нітробарвників і низки інших сполук.
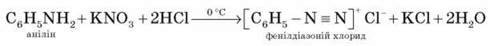
За більш високої температури реакція відбувається з виділенням азоту, а анілін перетворюється на фенол:
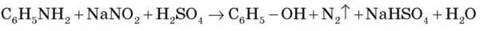
4. Застосування аніліну. Шкідливий вплив на людину
1) Головна галузь застосування аніліну – синтез барвників і лікарських засобів.
Промислове виробництво фіолетового барвника мовеїну на базі аніліну почалося в 1856 р. Шляхом окиснення аніліну хромовою сумішшю (K2Cr2O7 + H2SO4) одержують “аніліновий чорний” – барвник для тканини.
Наразі переважна частина (85 %) виробленого у світі аніліну використовується для виробництва метилдіізоціанатів, що надалі застосовуються для виробництва поліуретанів. Анілін також використовується у виробництві штучних каучуків (9 %), гербіцидів (2 %) і барвників (2 %).
Отже, анілін застосовується переважно як напівпродукт у виробництві барвників, вибухових речовин і лікарських засобів (сульфаніламідні препарати), але з огляду на очікуване зростання обсягів виробництва поліуретанів можлива значна зміна картини споживачів у середньостроковій перспективі.
2) Анілін впливає на центральну нервову систему, спричиняє кисневе голодування організму за рахунок утворення в крові метгемоглобіну, гемолізу й дегенеративних змін еритроцитів. В організм анілін потрапляє під час дихання, у вигляді парів, а також крізь шкіру та слизові оболонки. Усмоктування крізь шкіру посилюється в разі нагрівання повітря або вживання алкоголю.
У разі легкого отруєння аніліном спостерігаються слабкість, запаморочення, головний біль, синюшність губ, вушних раковин і нігтів. У випадку отруєнь середньої тяжкості також спостерігаються нудота, блювота, іноді хитання під час ходьби, частішання пульсу. Тяжкі випадки отруєння є вкрай рідкими.
У разі хронічного отруєння аніліном (анілізм) виникають токсичний гепатит, а також нервово-психічні розлади, розлади сну, погіршення пам’яті тощо.
У випадку отруєння аніліном необхідно насамперед вивести потерпілого з осередку отруєння, обмити теплою (але не гарячою!) водою. Також потрібне вдихання кисню з карбогеном. Крім цього, застосовують кровопускання, уведення антидотів (метиленова синь), серцево-судинних засобів. Слід забезпечити потерпілому спокій.
IV. Підбиття підсумків уроку
Підбиваємо підсумки уроку, оцінюємо роботу учнів на уроці.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: знайти інформацію за темою “Вплив аніліну на навколишнє середовище”.