Електролітична дисоціація. Електроліти й неелектроліти
Тема 1
РОЗЧИНИ
Урок 11
Тема уроку. Електролітична дисоціація. Електроліти й неелектроліти
Цілі уроку: формувати уявлення учнів про процеси, що відбуваються в розчинах; ознайомити з поняттям “електролітична дисоціація”; пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника; ознайомити учнів з поділом речовин на електроліти й неелектроліти за електропровідністю в розчині або розплаві.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь учителя, демонстраційний
Обладнання: таблиця розчинності, прилад для визначення електропровідності в розчинах, медіа-фрагмент “Схема дисоціації NaCl і HCl”. Демонстрація 3. Дослідження речовин та їхніх розчинів на електропровідність. В окремих склянках речовини: дистильована вода, кухонна сіль, цукор, лимонна кислота, сода, розчини хлоридної кислоти, натрій гідроксиду, натрій сульфату.
ХІД УРОКУ
I. Організація класу
II. Аналіз практичної роботи № 1, оголошення оцінок
III. Оголошення теми й цілей уроку.
Мотивація навчальної діяльності
Демонстраційний експеримент 3. Дослідження речовин та їхніх розчинів
З курсу природознавства й фізики ми пам’ятаємо, що метали проводять електричний струм.
– Хто може пояснити, чому ця властивість притаманна металам? (Металевий зв’язок, металеві кристалічні гратки, вільні електрони в кристалічних гратках і катіони у вузлах)
– Який метал має найвищу електропровідність? (Срібло, золото, мідь)
– Назвіть речовини, що проводять електричний струм (крім металів) і мають вільні електрони. (Графіт)
– Чи проводить електричний струм вода? (Так, ні)
Проведемо експеримент: занурюємо електроди в дистильовану
Воду й подаємо струм у систему. Лампочка не горить. Висновок – ланцюг розімкнений, дистильована вода не проводить електричний струм.
Нагадуємо, що електричні прилади не можна гасити водою, не можна торкатися електричних дротів, електричних приладів мокрими руками. Чому? (Тому що водопровідна вода проводить електричний струм)
Перевіряємо водопровідну воду приладом – лампа горить. Проблемне питання: Чому? Чим відрізняються дистильована й водопровідна вода? (Наявністю розчинених у них солей)
Проведемо експеримент.
Сухі електроди зануримо в сухий натрій хлорид – лампочка не горить. Тепер приєднаємо до приладу склянку з дистильованою водою й акуратно шпателем насиплемо кілька кристалів натрій хлориду. Спостерігаємо за лампою, що поступово розгоряється.
Висновок: розчинені у воді кристали зробили розчин електропровідним.
– Чи всі речовини здатні так змінювати воду?
Проведемо аналогічне дослідження із содою, цукром, лимонною кислотою. Робимо висновок:
– розчин цукру не проводить електричний струм;
– розчин лимонної кислоти проводить електричний струм;
– розчин соди проводить електричний струм.
Розглянемо електропровідність інших розчинів (NaОH, HCl, Na2SО4).
Речовини, розчини й розплави яких проводять електричний струм, називаються електролітами. (До них належать усі солі, кислоти, основи, більшість основних оксидів, тобто речовини з іонним і ковалентним полярним типами зв’язку.)
Речовини, розчини й розплави яких не проводять електричний струм, називаються неелектролітами. (Це прості речовини – неметали, речовини немолекулярної будови, більшість органічних речовин.)
IV. Вивчення нового матеріалу
Електролітична дисоціація
Чому розчини й розплави кислот, основ і солей проводять електричний струм?
Необхідно згадати особливості будови молекули H2О (диполь, з ковалентним полярним зв’язком).
У разі потрапляння у воду речовини з іонним зв’язком, наприклад NaCl (переглядаємо медіа-фрагмент – схему дисоціації натрій хлориду), диполі води орієнтуються відносно іонів цієї речовини протилежно зарядженими полюсами. У результаті електростатичної взаємодії між іонами розчиненої речовини й молекулами води відбувається гідратація іонів, що ослабляє зв’язок між ними, який поступово руйнується.
NaCl 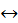 Na+ + Cl-
Na+ + Cl-
Утворюється два протилежно заряджені гідратовані іони.
Під час розчинення у воді речовин з ковалентним полярним зв’язком процесу дисоціації передує поляризація зв’язку (переглядаємо медіа-фрагмент – схему дисоціації HCl).
HCl 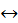 H+ + Cl-
H+ + Cl-
Такі уявлення про дисоціацію у водних розчинах сполук сформувалися не відразу. Сванте Арреніус та інші прихильники фізичної теорії назвали цей процес електролітичною дисоціацією.
Електролітична дисоціація – це розпад електролітів на іони в розчині або розплаві.
Основні положення теорії електролітичної дисоціації (ТЕД) сформулював шведський учений Сванте Арреніус у 1887 р., за що в 1901 р. отримав Нобелівську премію з хімії.
Основні положення ТЕД
– Дисоціація електролітів відбувається під дією полярних молекул розчинника.
– Дисоціація – оборотний процес. Зворотний процес називається асоціацією.
– Молекули, що дисоціюють, розпадаються на катіони й аніони, причому заряд усіх катіонів дорівнює сумарному заряду всіх аніонів.
Під дією електричного струму в розчині виникає спрямований рух йонів: катіонів – до катода, аніонів – до анода.
Уперше припущення, що в розчині відбувається сполучення речовини й розчинника, висловив Д. І. Менделєєв.
Згодом І. О. Каблуков і В. О. Кистяковський об’єднали обидві теорії й показали, що розчинення – складний фізико-хімічний процес.
Розглянемо на прикладах:
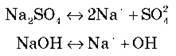
Самостійно запишіть рівняння дисоціації речовин:
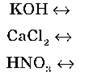
V. Підбиття підсумків уроку
Сьогодні ми дізналися, що розчинення – складний процес.
– Які явища супроводжують розчинення?
– Чи завжди в розчині протікатимуть усі перелічені процеси?
Розгляньмо це на прикладі трьох речовин:
NaCl | C12H22O11 | H2SO4 | |
Руйнування граток | + | + | – |
Дифузія | + | + | + |
Гідратація | + | + | + |
Дисоціація | + | – | + |
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Написати рівняння дисоціації в розчинах таких речовин: K2SO4, H2SO4, RbOH, BaCl2, HBr, AlCl3.