Карбонові кислоти – КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина III. ОРГАНІЧНА ХІМІЯ
Розділ 17. КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
§ 17.10. Карбонові кислоти
Карбоновими кислотами називаються органічні сполуки, в молекулах яких міститься функціональна карбоксильна група (карбоксил) 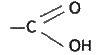
Назва “карбоксил” походить від слів карбоніл та гідроксил.
Якщо в молекулі міститься одна карбоксильна група, то кислота називається одноосновною, дві – двохосновною і т. д.
Наведемо приклади представників
Н-СООН – мурашина кислота;
СН3-СООН – оцтова кислота;
СН3-СН2-СООН – пропіонова кислота;
СН3-СН2-СН2-СООН – масляна кислота;
СН3-СН2-СН2-СН2-СООН – валеріанова кислота;
СН3-(СН2)4-СООН – капронова кислота;
СН3-(СН2)5-СООН – енантова кислота;
…………………………………………………………………
СН3-(СН2) 14-СООН – пальмітинова кислота;
………………………………………………………………….
СН3-(СН2) 16-СООН
Як видно з прикладів, карбонові кислоти можна розглядати як похідні вуглеводнів, у яких атоми водню заміщені карбоксильними групами. Загальна формула гомологічного ряду СnН2n+1СООН або R-СООН (у першого гомолога замість R – атом водню).
За систематичною номенклатурою назви кислот походять від назв відповідних вуглеводнів з додаванням закінчення – ова і слова кислота. Наприклад:
НСООН – метанова кислота; СН3СООН – етанова кислота;
СН3-СН2СООН – пропанова кислота;
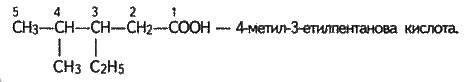
Ізомерія кислот залежить від будови радикала. Ізомери з’являються, починаючи з масляної кислоти С3Н7СООН:
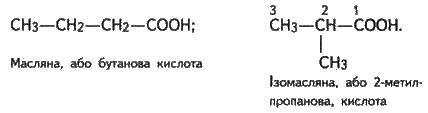
Властивості карбонових кислот. Хімічні властивості карбонових кислот зумовлені наявністю в їх молекулах карбоксильних груп. Електронну будову карбонових кислот можна представити схемою
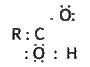
Атом кисню, сполучений з вуглецем подвійним зв’язком, відтягує електрони до себе. Вуглець набуває деякого позитивного заряду і притягує до себе електрони від другого атома кисню з групи – ОН, що спричиняє зміщення електронної хмари зв’язку O-Н до атома кисню. Взаємний вплив атомів у карбоксильній групі можна зобразити схемою:
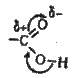
У результаті взаємного впливу атомів у карбоксильній групі зв’язок С=O міцніший, ніж у карбонільній групі, а зв’язок О-Н менш міцний, ніж у спиртах.
Карбонові кислоти мають високі температури кипіння, що пов’язано з утворенням водневих зв’язків між молекулами, наприклад:
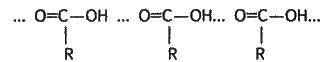
У водних розчинах карбонові кислоти, як і мінеральні, дисоціюють на іони з утворенням іонів гідроксонію:
RCOOH + Н2O ⇆ Н3О+ + RCOO-.
Усі карбонові кислоти – слабкі електроліти (НСООН – середньої сили). Карбонові кислоти виявляють усі властивості мінеральних кислот (див. § 6.2).
У карбонових кислотах під впливом карбоксильної групи збільшується рухливість атомів водню, які стоять біля атома вуглецю, сусіднього з карбоксильною групою. Тому вони можуть легко заміщуватися атомами хлору або брому:
СН3СООН + Сl2 −> СН2СlСООН + НСl;
2-Хлоретанова
(хлороцтова) кислота
СН3СН2СООН + Вr2 −> СН3СНВrСООН + НВr.
2-Бромпропанова кислота
Очевидно, радикали, які містять хлор чи бром, повинні впливати на кислотність карбоксильної групи. І дійсно, ступінь дисоціації хлороцтової кислоти приблизно в 10 разів більший, ніж оцтової, а трихлороцтова кислота за силою близька до хлоридної чи сульфатної. У цьому випадку послаблення зв’язку водню у гідроксильній групі можна зобразити схемою:
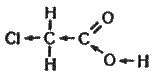
Характерною властивістю карбонових кислот є взаємодія їх зі спиртами з утворенням складних ефірів (див. § 17.13).
Важливе значення мають кислоти: пальмітинова С17Н35СООН і стеаринова С17Н31СООН – тверді речовини, а також рідка ненасичена олеїнова кислота С17Н33СООН.
Залишки цих одноосновних кислот входять до складу жирів і масел (див. § 17.14).
Загальний спосіб добування карбонових кислот полягає в окисненні первинних спиртів і альдегідів.
Детальніше властивості кислот розглянуто на прикладі мурашиної та оцтової.