Контрольна робота № 1 з теми “Неметали та їхні сполуки”
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 16
Тема уроку. Контрольна робота № 1 з теми “Неметали та їхні сполуки”
Цілі уроку: узагальнити та скоригувати знання учнів з теми “Неметали та їхні сполуки”; визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок.
Форми роботи: письмова контрольна робота за варіантами.
Обладнання: картки-завдання.
ХІД УРОКУ
І. Організація
ІІ. Письмова контрольна робота
Учитель розподіляє варіанти й нагадує учням зміст завдань, час виконання, ключові моменти оформлення відповідей і систему оцінювання:
– завдання 1, 2, 3, 4, 5, 6 – тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань дають 3 бали;
– завдання 7, 8, 9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Отже, максимальна оцінка за правильно виконану роботу становить 12 балів.
Час на виконання роботи – 40
ІІІ. Домашнє завдання
Підготувати повідомлення про застосування нітратної та фосфатної кислот.
Варіант І
1. Формула вищого оксиду елементів підгрупи Оксигену:
А) Е2O3;
Б) EO2;
В) EO3;
Г) E2O5.
2. Амоніак за фізичними властивостями:
А) газ жовтого кольору без запаху, розчинний у воді;
Б) безбарвний газ із різким запахом, розчинний у воді,
В) безбарвний газ без запаху, розчинний у воді.
3. Алотропними видозмінами Сульфуру є сірки:
А) червона й чорна;
Б) жовта й коричнева;
В) кристалічна й пластична.
4. Кількість зв’язків між атомами Нітрогену в молекулі азоту:
А) один;
Б) два;
В) три.
5. Найбільша кількість азоту в природі міститься:
А) у повітрі;
Б) у грунті;
В) у воді.
6. Формула вищого гідроксиду елементів підгрупи Карбону:
А) HEO3;
Б) H2EO3;
В) HEO4;
Г) H2EO4.
7. Здійсніть схему перетворень: 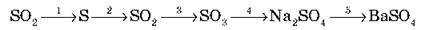
8. Реакцію 5 запишіть у іонно-молекулярній формі.
9. До розчину сульфатної кислоти масою 4,9 г додали кальцій карбонат масою 10 г. Обчисліть об’єм вуглекислого газу (н. у.), що утворився в результаті реакції.
10. Обчисліть об’єм амоніаку (н. у.), який можна одержати в результаті взаємодії амоній хлориду масою 30 г з надлишком кальцій гідроксиду, прийнявши, що об’ємна частка виходу амоніаку становить 92 %.
Варіант ІІ
1. Розподіл електронів на зовнішньому рівні атомів елементів підгрупи Оксигену:
А) s2 p3 d1;
Б) s2 p4 d0;
В) s1 p3 d2.
2. Виберіть фізичні властивості азоту:
А) газ;
Б) газ без запаху;
В) безбарвний газ без запаху;
Г) безбарвний газ без запаху, не розчинний у воді.
3. До фізичних властивостей сульфатної кислоти належать такі:
А) газ;
Б) масляниста рідина;
В) відсутність кольору;
Г) жовтий колір;
Д) відсутність запаху;
Е) слабкий запах.
4. Установіть відповідність:
Формула Назва
1. NH3 А. Амоній хлорид
2. NH4OH Б. Амоніак
3. NH4Cl В. Амоній гідроксид
5. Сірка в природі поширена:
А) лише у вільному стані;
Б) лише у зв’язаному стані;
В) і у вільному, і у зв’язаному станах.
6. Характерними ступенями окиснення елементів підгрупи Карбону є:
А) +4, +2, -4;
Б) +3, +5, -1, -2, -3;
В) +4, +5, -3.
7. Здійсніть схему перетворень: 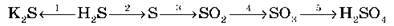
8. Реакцію 1 запишіть у іонно-молекулярній формі.
9. Обчисліть об’єм водню (н. у.), що виділиться в результаті взаємодії розчину сульфатної кислоти масою 17,6 г з алюмінієм масою 2,7 г.
10. У результаті взаємодії кальцій гідроксиду масою 37 г з амоній сульфатом одержали 15 г амоніаку. Обчисліть масову частку виходу амоніаку.
Варіант ІІІ
1. Характерними ступенями окиснення елементів підгрупи Нітрогену є:
А) +1, +2, +3, +5, -1, -2, -3;
Б) +3, +5, -1, -2, -3;
В) +3, +5, -3.
2. Сульфур(IV) оксид за хімічними властивостями належить до групи:
А) основних;
Б) кислотних;
В) амфотерних.
3. Фосфор у природі поширений у стані:
А) вільному;
Б) зв’язаному;
В) і у вільному, і у зв’язаному.
4. червоний фосфор застосовується:
А) як добриво;
Б) для виготовлення іграшок;
В) для виготовлення сірників.
5. Природною сполукою Силіцію є:
А) кварц;
Б) халцедон;
В) пірит;
Г) крейда.
6. До фізичних властивостей сульфур(VI) оксиду належать такі:
А) рідина;
Б) газ;
В) відсутність запаху;
Г) запах;
Д) розчинний у воді;
Е) нерозчинний у воді.
7. Напишіть рівняння реакцій для здійснення схеми перетворень: 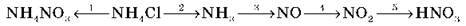
8. Реакцію 1 запишіть у іонно-молекулярній формі.
9. Обчисліть об’єм сірчистого газу (н. у.), що виділиться в результаті взаємодії сірки масою 9,6 г з киснем об’ємом 4,48 л (н. у.).
10. Обчисліть масу нітратної кислоти, яку можна одержати з натрій нітрату масою 17 г у результаті його взаємодії з концентрованою сульфатною кислотою, якщо масова частка виходу нітратної кислоти становить 96 %.