Контрольна робота з теми “Металічні елементи та їхні сполуки”
ІІ семестр
Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин)
УРОК 34
Контрольна робота з теми “Металічні елементи та їхні сполуки”
Цілі уроку: узагальнити й систематизувати знання учнів з теми “Металічні елементи та їхні сполуки”; визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок.
Форми роботи: письмова контрольна робота.
ХІД УРОКУ
I. Організація класу
II. Письмова контрольна
Учитель розподіляє варіанти й нагадує учням зміст завдань, час виконання, ключові моменти оформлення відповідей і систему оцінювання:
– завдання 1, 2, 3, 4, 5, 6 – тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань дають 3 бали;
– завдання 7, 8, 9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань учень отримує 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Отже, максимальна оцінка за правильно виконану роботу становить 12 балів.
Час на виконання роботи – 40 хв.
Варіант І
1. Під час
А) віддають електрони зовнішнього енергетичного рівня;
Б) приєднують електрони зовнішнього енергетичного рівня;
В) не змінюють зовнішнього енергетичного рівня.
2. Електроліз переважно використовують для одержання:
А) малоактивних металів;
Б) найбільш активних металів;
В) металів, що в ряду активності розташовуються після водню.
3. Найбільшу електро – й теплопровідність має метал:
А) Са;
Б) Al;
В) Ag.
4. Укажіть рівняння можливої хімічної реакції:
А) Mg + Pb(NO3)2 
Б) Ag + Cu(NO3)2 
В) Zn + Mg(NO3)2 
5. Укажіть окисник у реакції: Ca + H2O  Ca(OH)2 + H2
Ca(OH)2 + H2
А) Са;
Б) H2O;
В) H2.
6. Об’єм водню, що виділяється в результаті взаємодії заліза масою 2,8 г з надлишком розбавленої сульфатної кислоти:
А) 3,36 л;
Б) 2,24 л;
В) 1,12 л.
7. Запишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
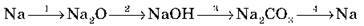
Перше рівняння розберіть як ОВР, друге і третє запишіть у молекулярно-іонній формі.
8. Допишіть рівняння можливих реакцій:
1) K + H2O 
2) Al + С 
3) Cu + FeSO4 
4) Fe + H2SO4 (конц.) 
9. Унаслідок взаємодії лужного металу масою 2,76 г з надлишком води виділився газ об’ємом 1,344 л (н. у.). Визначте метал.
10. Обчисліть масу магнітного залізняку, з якого одержали 5,6 т заліза в результаті відновлення карбон(II) оксидом, якщо масова частка Fe3O4 в руді становить 0,8 %.
Варіант ІІ
1. Метали реагують з розчином солі, якщо:
А) до складу солі входить більш активний метал;
Б) до складу солі входить метал такої ж активності;
В) метал-реагент активніший за той, що входить до складу солі.
2. Сплави складаються:
А) тільки з металів;
Б) з металів і неметалів;
В) тільки з неметалів.
3. Найвищу твердість мають метали:
А) Cu, Fe;
Б) Cr, Ті;
В) Cr, W.
4. Укажіть неможливу реакцію:
А) Zn + AgNO3 
Б) Zn + CuCl2 
В) Ag + CuSO4 
5. Укажіть відновник у реакції: 2Al + 6HCl = 2AlCl3 + 3H2
А) Al;
Б) H+;
В) H2.
6. У результаті реакції кальцію масою 2 г з надлишком води виділився водень об’ємом:
А) 2,24 л;
Б) 1,12 л;
В) 1,24 л.
7. Запишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
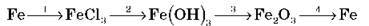
8. Допишіть рівняння можливих реакцій:
1) Ca + H2O 
2) Fe + HNO3 (конц.) 
3) Ni + AlCl3 
4) Al(OH)3 + HCl 
9. На двовалентний метал масою 6 г подіяли водяною парою, унаслідок чого виділився газ об’ємом 5,6 л (н. у.). Визначте метал.
10. Обчисліть витрату глинозему, масова частка алюміній оксиду в якому становить 95 %, у процесі електролітичного одержання 1 т алюмінію.
Варіант ІІІ
1. З водою за звичайних умов реагують метали:
А) побічних підгруп I-III груп;
Б) головних підгруп I-II груп;
В) побічної підгрупи VIII групи.
2. Для вповільнення корозії використовують:
А) покриття активного металу менш активним;
Б) покриття неметалу металом;
В) покриття металу іншим металом з такою ж активністю.
3. До легких металів належать:
А) Li, Na, Al;
Б) Fe, Cu, Ag;
В) Zn, Pb, Au.
4. Укажіть неможливу реакцію:
А) CuSO4 + Zn 
Б) Zn (NO3)2 + Ni 
В) PbCl2+ Zn 
5. Укажіть відновник у реакції: 2Fe + 3Br2  2FeBr3
2FeBr3
А) Fe3+;
Б) Br2;
В) Fe.
6. Запишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:

7. Допишіть рівняння можливих реакцій:
1) ZnCl2 + Cu 
3) Al + S 
2) Na + H2O 
4) Fe + Mg (NO3)2 
8. На одновалентний метал масою 5,85 г подіяли надлишком води. Виділився газ об’ємом 1,68 л (н. у.). Визначте метал.
9. Обчисліть теоретичні витрати коксу, необхідні для відновлення заліза з 400 т руди, масова частка ферум(ІІІ) оксиду в якій становить 92 %. Кокс при цьому окислюється до С02.
ІІІ. Домашнє завдання
Повторити матеріал про властивості металічних елементів та їхніх сполук.