Контрольна робота з теми “Неметали та їхні сполуки”
ІІ семестр
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (продовження)
УРОК 22
Тема уроку. Контрольна робота з теми “Неметали та їхні сполуки”
Цілі уроку: узагальнити та скоригувати знання учнів з теми “Неметали та їхні сполуки”; визначити рівень навчальних досягнень учнів з теми, розуміння учнями основних понять, уміння використовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок.
Форми роботи: письмова контрольна робота за варіантами.
Обладнання: періодична таблиця хімічних елементів,
ХІД УРОКУ
I. Організація класу
II. Письмова контрольна робота
Учитель розподіляє варіанти й нагадує учням зміст завдань, час виконання та ключові моменти оформлення відповідей і систему оцінювання:
– завдання 1, 2, 3, 4, 5, 6 – тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань дають 3 бали;
– завдання 7, 8, 9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Отже, максимальна оцінка за
Час на виконання роботи – 40 хв.
Варіант І
1. Проста речовина хлор:
А) важкий газ зеленого кольору;
Б) бура летка рідина;
В) отруйна речовина;
Г) добре розчиняється у воді.
2. Якісна реакція на карбонат-іон:
А) дія розчинних солей Аргентуму;
Б) дія розчинних солей Барію;
В) дія сильних кислот;
Г) дія індикатора.
3. Тільки окисні властивості Сульфур проявляє в сполуці:
А) SO3;
Б) H2S;
В) SO2;
Г) H2SO3.
4. Скло для шибок одержують у результаті сплавлення:
А) Na2CO3, CaCO3, SiO2;
Б) Na2Cl, CaCO3, SiO2;
В) CaCl2, CaCO3, SiO2;
Г) Na2CO3, NaCl, SiO2.
5. Формула нітратної кислоти:
А) HNO2;
Б) N2O3;
В) HNO3;
Г) H3N.
6. Солі фосфатної кислоти застосовуються:
А) як вибухові речовини;
Б) для виробництва добрив;
В) для виготовлення гуми.
7. Запишіть рівняння реакції для здійснення перетворень: 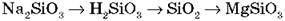
8. Напишіть іонно-молекулярні рівняння реакції взаємодії:
А) натрій сульфіту та хлоридної кислоти;
Б) амоній нітрату й барій гідроксиду.
9. Аргентум нітрат масою 8,5 г прореагував із хлоридною кислотою. Випав білий нерозчинний осад масою 7 г. Обчисліть масову частку виходу продукту реакції від теоретично можливого.
10. Крізь розчин кальцій гідроксиду масою 50 г з масовою часткою 74 % пропустили карбон(IV) оксид об’ємом 12,5 л (н. у.). Обчисліть масу солі, що утворилася.
Варіант ІІ
1. Алотропні модифікації Карбону:
А) алмаз і графіт;
Б) білий і чорний;
В) алмаз і кварц;
Г) метан і вугілля.
2. Якісна реакція на хлорид-іон:
А) дія розчинних солей Аргентуму;
Б) дія розчинних солей Барію;
В) дія сильних кислот;
Г) дія індикатора.
3. Тільки відновні властивості Нітроген проявляє в речовині:
А) NO2;
Б) N2;
В) HNO3;
Г) HSN.
4. Рідке скло має формулу:
А) Na2SiO3;
Б) CaSiO3;
В) CaSiO3;
Г) Na2C03.
5. Ортофосфатна кислота є:
А) одноосновною;
Б) двохосновною;
В) трьохосновною.
6. Нітратна кислота застосовується:
А) у медицині;
Б) у виробництві вибухових речовин;
В) у радіотехніці.
7. Запишіть рівняння реакції для здійснення перетворень: СО2  KHCО3
KHCО3  K2CО3
K2CО3  KCl
KCl
8. Напишіть іонно-молекулярні рівняння реакцій взаємодії:
А) амоній сульфату й калій гідроксиду;
Б) натрій силікату й нітратної кислоти.
9. Залізо масою 5,6 г згоріло в атмосфері хлору. Утворився ферум(ІІІ) хлорид масою 15,25 г. Обчисліть масову частку виходу продукту реакції від теоретично можливого.
10. До розчину сульфатної кислоти масою 98 г з масовою часткою кислоти 10 % додали натрій гідроксид масою 10 г. Обчисліть масу солі, що утворилася.
Варіант ІІІ
1. Азот перебуває в природі:
А) у вигляді простих і складних речовин;
Б) тільки у вільному стані;
В) тільки у зв’язаному стані;
Г) у вільному стані тільки в космосі.
2. Якісна реакція на сульфат-іон:
А) дія розчинних солей Аргентуму;
Б) дія розчинних солей Барію;
В) дія сильних кислот;
Г) дія індикатора.
3. Тільки відновні властивості Карбон проявляє в ступені окиснення:
А) +2;
Б) +4;
В) -4;
Г) 0.
4. Силікатна промисловість виготовляє:
А) цемент, бетон, пісок;
Б) цемент, скло, залізобетон;
В) цемент, скло, кераміку;
Г) цемент, скло, гуму.
5. Концентрована сульфатна кислота пасивує:
А) Al, Fe, Cr;
Б) Zn, Fe, Cr;
В) Fe, Al, Pb;
Г) Al, Zn, Pb.
6. Амоніак застосовується:
А) у медицині;
Б) у будівництві;
В) у металургії.
7. Запишіть рівняння реакції для здійснення перетворень: KNO3  O2
O2  P2O5
P2O5  H3PO4
H3PO4
8. Напишіть іонно-молекулярні рівняння реакції взаємодії:
А) калій карбонату та хлоридної кислоти;
Б) алюміній сульфату й барій хлориду.
9. У результаті нагрівання магнію масою 2,4 г з фосфором утворився магній фосфід масою 4 г. Обчисліть масову частку виходу продукту реакції від теоретично можливого.
10. Технічний барій карбонат масою 24,6 г з масовою часткою карбонату 20 % прореагував із хлоридною кислотою масою 8,6 г. Обчисліть об’єм газу, що утворився (н. у.).
ІІІ. Домашнє завдання
Повторити матеріал параграфів про неметалічні елементи та їхні сполуки.