Твердість води та способи її усунення – МЕТАЛИ ГОЛОВНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП
§ 13.9. Твердість води та способи її усунення
У природі чистої води не буває: вона завжди містить домішки яких-небудь речовин. Зокрема, взаємодіючи із солями, що містяться в земній корі, вона набуває певної твердості.
Твердість води – сукупність властивостей, зумовлених вмістом у воді катіонів кальцію Са2+ і катіонів магнію Мg2+. Якщо концентрація цих катіонів велика, то воду називають твердою, якщо мала
2С17Н35СОO – + Са2+ = (С17Н35СОО)2 Са↓;
2С17Н35СОО – + Мg2+ = (С17Н35СОО)2 Мg↓,
І піна утворюється лише після повного осадження цих катіонів. Щоправда, деякі синтетичні мийні засоби добре миють і у твердій воді, оскільки їх кальцієві і магнієві солі легко розчиняються. У твердій воді погано розварюються харчові продукти, а зварені у ній овочі несмачні. Дуже погано заварюється чай, і смак його втрачається.
Тверда вода непридатна для використання у парових котлах: розчинені у ній солі під час кип’ятіння утворюють на стінках котлів шар накипу, який погано проводить теплоту. Це призводить до перевитрат палива, передчасного зносу котлів, а іноді, внаслідок перегрівання котлів, і до аварії. Твердість води шкідлива для металевих конструкцій, трубопроводів, кожухів охолоджуваних машин.
Катіони кальцію Са2+ зумовлюють кальцієву твердість, а катіони Мg2+ – магнієву твердість води. Загальна твердість складається з кальцієвої і магнієвої, тобто із сумарної концентрації у воді катіонів Са2+ і Мg2+.
Відносно процесів зм’якшення води розрізняють твердість карбонатну і некарбонатну. Карбонатною називається твеpдість, зумовлена наявністю тієї частини катіонів Са2+ і Mg2+, яка еквівалентна гідрокарбонатним іонам НСО-3, що містяться у воді. Іншими словами, карбонатна твердість спричинена наявністю гідрокарбонатів кальцію і магнію. Під час кип’ятіння гідрокарбонати руйнуються, а малорозчинні карбонати, що утворюються, випадають в осад, і загальна твердість води зменшується на значення карбонатної твердості. Тому карбонатну твердість називають також тимчасовою твердістю. Під час кип’ятіння катіони Са2+ осідають у вигляді карбонату кальцію:
Са2+ + 2НСO-3 = СаСО3 ↓ + Н2О + СO2,
А катіони магнію Mg – у вигляді основного карбонату або у вигляді гідроксиду магнію (при pH > 10,3):
2Мg2+ + 2НСО-3 + 2OН – = (МgОН)2 СО3 ↓ + Н2О + СО2
(гідроксид-іони ОН утворюються за рахунок взаємодії іонів НСО – з водою: НСО-3 + Н2О ⇆ Н2СО3 + ОН ).
Та частина твердості, що зберігається після кип’ятіння води, називається некарбонатною. Вона визначається вмістом у воді кальцієвих і магнієвих солей сильних кислот, переважно сульфатів і хлоридів. Під час кип’ятіння ці солі не видаляються, а тому некарбонатну твердість називають також постійною твердістю.
Розглянемо кількісну характеристику твердості води. Ступінь твердості води виражається по-різному. У нашій країні її виражають числом міліеквівалентів (мекв) катіонів Са2+ і Мg2+, які містяться в 1 л води. Оскільки 1 мекв твердості відповідає вмісту 20,04 мг/л катіонів С2+а або 12,16 мг/л катіонів Мg2+, то, згідно з визначенням, загальну твердість води Т (мекв/л) можна обчислити за формулою:
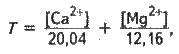
Де і – концентрації іонів Са2+ і Mg2+ , мг/л.
За значенням твердості природну воду розрізняють як дуже м’яку – з твердістю до 1,5; м’яку – від 1,5 до 4; середньої твердості – від 4 до 8; тверду – від 8 до 12 і дуже тверду – понад 12 мекв/л.
Твердість води господарсько-питних водопроводів не повинна перевищувати 7 мекв/л (ГОСТ 2874-82).
Дуже часто тверду воду перед використанням зм’якшують. Звичайно цього досягають обробкою води різними хімічними речовинами. Так, карбонатну твердість можна усунути додаванням гашеного вапна:
Са2+ + 2НСО-3 + Са2+ + 2OН – = 2СаСО3↓+ 2Н2О;
Мg2+ + 2НСО-3 + 2Са2+ + 4OН – = Мg(ОН)2↓ + 2СаСО3 і + 2Н2O.
При одночасному додаванні вапна і соди можна позбутися карбонатної і некарбонатної твердості (вапняно-содовий спосіб). Карбонатна твердість при цьому усувається вапном (див. вище), а некарбонатна – содою:
Са2+ + С02-3 = СаСО3↓; Мg2+ + СO2-3 = МgСО3
І далі
МgСО3 + Са2+ + 2OН – = Мg(ОН)2 ↓ + СаСО3 ↓.
Застосовують й інші способи усунення твердості води, серед яких один з найсучасніших грунтується на застосуванні катіонітів (катіонітний спосіб). Є такі тверді речовини, які містять у своєму складі рухливі іони, здатні обмінюватися на іони зовнішнього середовища. Вони дістали назву іонітів. Особливо поширені іонообмінні смоли, які добувають на основі синтетичних полімерів.
Іоніти (іонообмінні смоли) поділяють на дві групи. Одні з них обмінюють свої катіони на катіони середовища і називаються катіонітами, інші обмінюють свої аніони і називаються аніонітами. Іоніти не розчиняються у розчинах солей, кислот і лугів.
Катіоніти мають вигляд чорних або темно-бурих зерен діаметром від 0,5 до 2 мм (КУ-1, КУ-2, СБС та інші), аніоніти – зернисті речовини білого, рожевого або коричневого кольору (АВ-16, АВ-17, АН-2Ф та інші).
Для усунення твердості води застосовують катіоніти – синтетичні іонообмінні смоли і алюмосилікати, наприклад Na2 . їх склад умовно можна виразити загальною формулою Na2R, де Na – досить рухливий катіон і R2 – частинка катіоніту, що несе від’ємний заряд. Так, у наведеному прикладі R2 = 2- .
Якщо пропускати воду крізь шари катіоніту, то іони натрію будуть обмінюватися на іони кальцію і магнію. Схематично ці процеси можна виразити рівняннями:
Са2++ Na2R =2Na+ + CaR;
Mg2++ Na2R = 2Na+ + MgR.
Отже, іони кальцію і магнію переходять з розчину в катіоніт, а іони натрію – з катіоніту в розчин; твердість при цьому усувається.
Після використання більшої частини іонів натрію катіоніти звичайно регенерують – витримують у розчині хлориду натрію, за участю якого відбувається зворотний процес: іони натрію заміщують у катіоніті іони кальцію і магнію, які переходять у розчин:
CaR + 2Na+ = Na2R + Са2+; MgR + 2Na+ = Na2R + Mg2+.
Регенерований катіоніт знову можна використовувати для зм’якшення нових порцій твердої води.