Характеристика хімічного елемента за його місцем періодичній системі та будовою атома
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 6. Характеристика хімічного елемента за його місцем періодичній системі та будовою атома
Усвідомлення змісту цього параграфа дає змогу:
Визначати місце хімічного елемента у періодичній системі; пояснювати будову атома хімічного елемента;
Характеризувати за місцем елемента у періодичній системі та будовою атома властивості простої речовини, склад і характер вищого оксиду та гідроксиду, склад леткої сполуки з Гідрогеном (де можливо).
Пригадайте:
–
– основні закономірності зміни властивостей атомів, простих і складних речовин, утворених хімічними елементами, у періодах і групах.
Нині, коли встановлено зв’язок між ученням про періодичність і теорією будови атомів, можна доволі повно характеризувати хімічні елементи. Краще це робити за певним планом.
План характеристики хімічного елемента
1. Хімічний знак і назва елемента.
2. Місце хімічного елемента у періодичній системі (атомний номер, відносна атомна маса, період, група).
Хлор Cl
Атомний номер 17
Ar (Cl) = 35,5 3-й період
VІІА
3. Будова атома хімічного елемента (заряд ядра атома; число протонів, нейтронів, електронів у атомі; розподіл електронів за енергетичними рівнями). Вид елемента (неметалічний або металічний).
4. Характер простої речовини, утвореної ато мами цього елемента (метал, перехідний метал, неметал).
5. Склад вищого оксиду, його характер (основний, кислотний, амфотерний).
6. Склад вищого гідроксиду, його характер (кислота, основа, амфотерний гідроксид).
7. Склад леткої сполуки з Гідрогеном (для неметалічних елементів).

Покажемо на прикладі Магнію, як ще можна характеризувати хімічний елемент.
1. Mg – Магній.
2. Елемент Магній має атомний номер 12, відносну атомну масу 24 (заокруглене значення). Розміщений у третьому періоді, в другій групі.
3. Оскільки атомний номер Mg Z = 12, то ядро атома Mg містить 12 протонів, заряд ядра +12. Число нейтронів у ядрі дорівнює:
N = Ar – Z = 24 – 12 = 12. Оскільки атом електронейтральний, то число електронів у атомі також дорівнює 12. Електрони утворюють в атомі три шари (три енергетичних рівні):
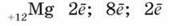
Електронна конфігурація атома Магнію 1s22s22p63s2 Виходячи з будови атома, можна передбачити ступінь окиснення Магнію в його сполуках. Оскільки під час хімічних реакцій атом Магнію віддає два зовнішніх електрони, виявляючи відновні властивості, то його ступінь окиснення дорівнює +2. Отже, Магній – типовий металічний елемент. Якщо порівняти з елементами-сусідами по групі, то відновні властивості у Магнію виявляються сильніше, ніж у Берилію Be, але слабкіше, ніж у Кальцію Са. Це пов’язано зі збільшенням радіусів атомів при переході від Ве до Mg і Са. У зв’язку з цим два зовнішніх електрони дедалі більше віддаляються від ядра, їхній зв’язок з ядром послаблюється, і атом легше втрачає їх, перетворюючись на позитивний двозарядовий йон.
4. Елемент Магній утворює просту речовину – магній, для якої характерні металічні кристалічні гратки і металічний хімічний зв’язок, тобто усі типові для металів властивості.
5. Магній оксид MgО є основним оксидом. Він виявляє всі типові властивості основних оксидів (пригадайте, які саме).
6. Елементу Магнію відповідає гідроксид Mg(OH)2 – основа, що виявляє всі характерні властивості основ (пригадайте, які саме).
7. Леткої сполуки з Гідрогеном Магній не утворює, а утворює тверду
Солеподібну сполуку –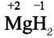 Магній гідрид.
Магній гідрид.
Характеристику хімічного елемента можна подати в скороченій формі, наприклад:

Такі характеристики можна навести для більшості хімічних елементів – металічних і неметалічних.
Коротко про головне
Періодичний закон і періодична система хімічних елементів
Д. І. Менделєєва дає змогу передбачати будову і властивості атомів
Елементів та утворених ними простих і складних речовин.