Загальна характеристика
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ
До ІVА групи періодичної системи належать Карбон С, Силіцій Si, Германій Ge, Станум Sn і Плюмбум Pb.
Карбон у вигляді сажі, кам’яного і деревного вугілля відомий з глибокої давнини. Назва Карбону походить від лат. carbo – вугілля.

Й. Берцеліус (1779 – 1848)

Д. І. Менделєєв і К. Вінклер (1894 р., Німеччина)
Силіцій (від лат. silex – кремінь, тобто камінь, що під час удару викресає іскру) відкрив шведський хімік
Германій, передбачений Д. Менделєєвим (1871), відкрив німецький учений К. Вінклер і назвав на честь Німеччини (1886).
Олово і свинець – прості речовини елементів Стануму і Плюмбуму – разом із золотом, сріблом, міддю, залізом і ртуттю входять до числа семи металів, відомих людині з давніх-давен.
§ 43. Загальна характеристика
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати і порівнювати хімічні елементи IVA групи за місцем у періодичній системі та електронною будовою атомів, їх поширеність у природі;
Пояснювати біологічну роль Карбону та Силіцію.
Електронна будова
Зі зростанням атомного номера елементів цієї групи відбувається закономірне збільшення розмірів їх атомів, зменшення електронегативності і, як наслідок, послаблення неметалічних і посилення металічних властивостей (табл. 13). Ось чому лише Карбон є типовим неметалічним елементом, у Силіцію і Германію з’являються металічні ознаки, а Станум і Плюмбум – метали. У даному розділі докладніше ознайомимося лише з Карбоном і Силіцієм та їх сполуками.
Т а б л и ц я 13
Загальна характеристика хімічних елементів IVA групи
Хімічний Елемент | Період | Атомний Номер | Відносна атомна маса | Радіус атома, нм | Електро-негативність | Валентні Електрони | Валентність | Ступені Окиснення | Неметалічні Властивості |
Карбон С | 2 | 6 | 12 | 0,077 | 2,50 | 2s22p2 | II, III, IV | +4, +2, 0, -4 | Послаблюються |
Силіцій Si | 3 | 14 | 28 | 0,135 | 1,74 | 3s23p2 | II, IV | +4, +2, 0, -4 | |
Германій Ge | 4 | 32 | 73 | 0,139 | 2,02 | 4s24p2 | II, IV | +4, +2 | |
Станум Sn | 5 | 50 | 119 | 0,158 | 1,72 | 5s25p2 | II, IV | +4, +2 | |
Плюмбум Pb | 6 | 82 | 207 | 0,175 | 1,55 | 6s26p2 | II, IV | +4, +2 | J |
Як елементи ІVА групи Карбон і Силіцій мають на зовнішньому енергетичному рівні незбудженого атома чотири валентних електрони та одну вільну орбіталь і належать до p-елементів. Конфігурація їх валентних електронів в основному стані ns2np2:
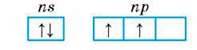
Завдяки двом неспареним електронам їх атоми можуть утворювати два ковалентні зв’язки і виявляти валентність ІІ (CS, SiO). Але Карбон, на відміну від Силіцію, в деяких сполуках здатний утворювати третій ковалентний зв’язок за донорно-акцепторним механізмом, надавши парі електронів атома Оксигену у молекулі CO вільну орбіталь атома Карбону:
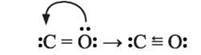
Отже, за кількістю утворених зв’язків Карбон у СО тривалентний, а Силіцій у SiO – двовалентний. Ступінь окиснення обох елементів у цих оксидах однакова й дорівнює +2.
При переході атомів у збуджений стан число неспарених електронів збільшується до чотирьох:
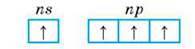
Це зумовлює здатність Карбону і Силіцію утворювати чотири ковалентні зв’язки і виявляти вищу валентність IV і ступені окиснення +4 з електронегативнішими елементами (СО2, SiO2) та -4 з елементами, менш електронегативними (СН4, SiH4).
Збуджений стан атомів і валентність IV для Карбону та Силіцію є найхарактернішими. В органічних сполуках ступінь окиснення Карбону може змінюватися від -4 до +4, наприклад:
-4 -3 -2 -1 0 +2 +3 +4
СН4, С2Н6, С2Н4, С2Н2, СН2Сl2, СНСl3, ССl3-СН3, ССl4.
Унікальною особливістю Карбону є здатність його атомів сполучатися один з одним й утворювати карбонові ланцюги різних типів: лінійні, розгалужені, циклічні. Саме цією властивістю пояснюється виняткова роль Карбону в існуванні життя на Землі.
Вищі оксиди Карбону і Силіцію типу ЕО2 є кислотними, відповідні їм гідроксиди Н2ЕО3 – кислоти. Летка сполука Карбону з Гідрогеном – метан СН4 є стійкою органічною сполукою. Силан SiH4 – малостійкий і самозаймається на повітрі. Метан і силан, на відміну від подібних сполук елементів VIIA – VA груп, не виявляють ані кислотних, ані основних властивостей. Це пояснюється низькою полярністю зв’язків С-Н і Si-Н унаслідок близьких за значенням електронегативностей атомів Карбону, Силіцію і Гідрогену.
Отже, Карбон і Силіцій є неметалічними елементами, але порівняно
З неметалічними елементами VIIA – VA груп виявляють ознаки неметалічності меншою мірою.
Поширеність у природі. Карбон є поширеним у природі елементом і трапляється у вигляді простих речовин (графіт, алмаз, вугілля) і неорганічних та органічних сполук. Вуглець – головна складова кам’яного і бурого вугілля, торфу.
В Україні є значні поклади бурого вугілля (Дніпропетровський вугільний басейн), кам’яного вугілля й антрациту (Донецький і Криворізький вугільні басейни).
Основу мінералів становлять карбонати: кальцит СаСО3 (вапняк, мармур, крейда), магнезит MgCO3, доломіт MgCO3 – СаСО3, поташ К2СО3, малахіт (CuOH)2CO3 (мал. 68). З карбонатів Кальцію і Магнію складаються корали, перли й панцири найпростіших. У повітрі в невеликій кількості є вуглекислий газ (0,03 % за об’ємом), у природній воді розчинені кислі солі – гідрогенкарбонати Кальцію та Магнію.
Силіцій за поширенням у земній корі (атомна частка 28 %) посідає друге місце після Оксигену й трапляється лише в літосфері Землі у вигляді силіцій(IV) оксиду SiO2 і силікатів. На їх частку припадає понад 3/4 маси планети. Кристалічний SiO2 (кварц) є основною складовою гранітів, пісковиків, морського піску, а також утворює різноманітні мінерали: гірський кришталь, агат, аметист, онікс, халцедон, яшма, опал тощо (мал. 69, 1 – 7).
Силікати, переважно Калію, Натрію, Кальцію, Магнію, Алюмінію, є основою гірських порід, що складаються з різноманітних мінералів: польового шпату (К2О – Аl2О3 – 6SiO2), глини (Аl2О3 – 2SiO2 – 2Н2О), слюди (силікати Калію, Алюмінію, Магнію), тальку (3МgO – 4SiO2 – Н2О), азбесту (“гірський льон”, 3МgO – 2SiO2 – 2Н2О) та ін. (мал. 69, 8 – 10).


Мал. 68. Природні сполуки Карбону:
А – мармур; б – магнезит; в – доломіт; г – поташ; г – малахіт



Мал. 69. Мінерали SiО2: 1 – агат;
2 – аметист; 3 – кварц; 4 – гірський кришталь; 5 – опал; 6 – халцедон; 7 – яшма. Мінерали силікатів:
8 – азбест; 9 – слюда; 10 – топаз
ЛАБОРАТОРНИЙ ДОСЛІД
ОЗНАЙОМЛЕННЯ ЗІ ЗРАЗКАМИ МІНЕРАЛІВ
Розгляньте видані вам зразки природних мінералів Карбону та Силіцію. Зверніть увагу на зовнішній вигляд. Перевірте їх твердість. Спостереження запишіть у таблицю.
Біологічна роль. Карбон – життєво важливий макроелемент організму людини, вміст якого досягає 21 % (15 кг на 70 кг маси тіла) і становить 2/3 маси м’язів і 1/3 маси кісткової тканини, входить до складу білків, нуклеїнових кислот, жирів, вуглеводів, ферментів, вітамінів, гормонів та мінеральних солей. Потрапляє в організм людини разом з питною водою (у вигляді гідрогенкарбонат-іонів НСО3) і харчовими продуктами. Антропогенними джерелами надходження Карбону в довкілля є аерозолі (суміші газів та частинок твердих речовин), що містять крім сажі (дрібні частинки вугілля) чадний і вуглекислий гази. Через органи дихання сажа потрапляє в організм людини і спричиняє хвороби верхніх дихальних шляхів, які можуть спровокувати захворювання на туберкульоз, онкологічні та ін. У разі постійного контакту шкіри людини із сажею можливий розвиток шкірних хвороб. Найчастіше вони виникають у шахтарів, робітників коксохімічних виробництв та цукрових заводів.
Силіцій належить до мікроелементів організму людини (2,1 г на 70 кг маси тіла людини) і міститься в крові, лімфатичних вузлах, кришталику ока, м’язах шлунка, підшлунковій залозі, кістковій тканині, зубах. Добове надходження Силіцію з їжею становить 3,5 мг, а з повітрям – близько 15 мг. Водночас деякі його сполуки згубно діють на організм людини. Найнебезпечнішим є азбест, який спричиняє захворювання шкіри, легень (азбестоз). Нагромадження в організмі людини пилу кремнезему SiO2 викликає захворювання на силікоз (ураження дихальних органів), а також утворення каменів у нирках, підшлунковій залозі.
Коротко про головне
До IVA групи хімічних елементів належать Карбон С, Силіцій Si, Германій Ge, Станум Sn і Плюмбум Pb. Карбон – типовий неметал, Германій, Станум і Плюмбум – метали і виявляють металічні властивості. Конфігурація валентних електронів ns2np2. Характерна валентність Карбону і Силіцію в сполуках IV, найвища ступінь окиснення +4, найнижча -4.
Карбон – це основа всього живого на Землі, трапляється як у вигляді простих, так і складних органічних та неорганічних речовин. Силіцій є основою літосфери Землі, за поширенням посідає друге місце після Оксигену. У природі трапляється лише у вигляді силіцій(IV) оксиду і силікатів.
Карбон – життєво важливий макроелемент, а Силіцій – мікроелемент організму людини.