Етиленгліколь і гліцерин – КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина III. ОРГАНІЧНА ХІМІЯ
Розділ 17. КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
§ 17.3. Етиленгліколь і гліцерин
Етиленгліколь. Етиленгліколь – представник насичених двохатомних спиртів – гліколів. Загальна формула гліколів ряду СnН2n(ОН)2. Назву гліколі одержали внаслідок солодкого смаку багатьох представників ряду (грец. “глікос” – солодкий).
Етиленгліколь (за систематичною номенклатурою етандіол-1,2) – сиропоподібна рідина, солодка на смак, без запаху, отруйна.
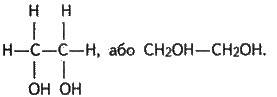
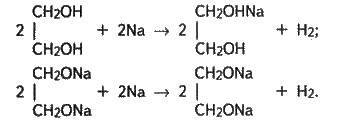
Хімічні властивості етиленгліколю в основному відповідають властивостям одноатомних спиртів. Тільки реакції відбуваються як з однією, так і з двома гідроксильними групами. Так, у реакції з лужними металами етиленгліколь утворює неповний і повний гліколяти:
Водні і спиртові розчини етиленгліколю застосовують як незамерзаючі при низьких температурах розчини, що замінюють воду в радіаторах автомобільних і авіаційних моторів у зимовий період, – антифризи. В багатьох
Гліцерин. Гліцерин – найпростіший представник насичених трьохатомних спиртів – гліцеринів. Це безбарвна, в’язка, гігроскопічна рідина, солодка на смак. Змішується з водою в будь-яких пропорціях. Добре розчиняє багато речовин.
На відміну від одноатомних спиртів етиленгліколь легко взаємодіє з гідроксидом купруму(ll), утворюючи яскраво-синій гліколят купруму:
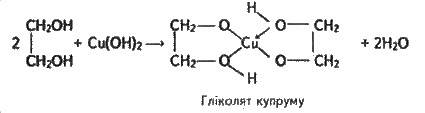
Гліколят купруму – складна (комплексна) сполука (стрілками вказано виникнення хімічних зв’язків за донорноакцепторним механізмом).
Етиленгліколь реагує також з їдкими лугами:

Етиленгліколь добувають окисненням етилену розчином перманганату калію:
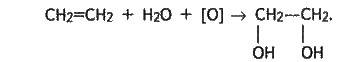
Його можна також добути обробкою дигалогенопохідних вуглеводнів водним розчином лугу:
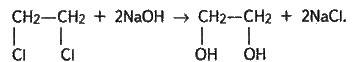
За хімічними властивостями гліцерин (за систематичною номенклатурою пропантріол-1,2,3) дуже подібний до етиленгліколю. Так, з гідроксидом купруму(ll) гліцерин утворює яскраво-синій гліцерат купруму:
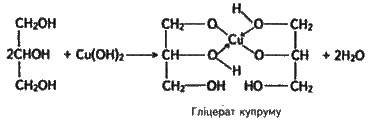
Це якісна реакція на багатоатомні спирти – етиленгліколь, гліцерин та їх гомологи.
Велике значення має реакція взаємодії гліцерину з нітратною кислотою з утворенням нітрогліцерину:
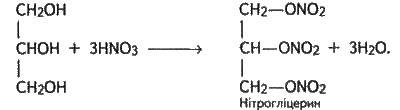
Нітрогліцерин1 – важка масляниста вибухова речовина (вибухає від легкого струсу і нагрівання). Однак спиртові розчини його не вибухають.
З карбоновими кислотами гліцерин утворює естери (складні ефіри) – жири і масла (див § 17.14).
Добувають гліцерин з жирів, а також синтезом – з газів крекінгу нафти (пропілену), тобто з нехарчової сировини. В останньому випадку його промислове виробництво можна представити схемою:
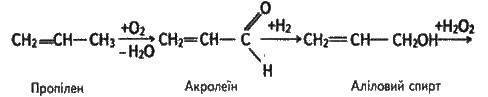
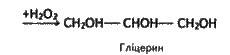
Гліцерин застосовується для виробництва нітрогліцерину (вибухівка), приготування антифризів, у косметиці (пом’якшує шкіру), у шкіряній промисловості. Однопроцентний спиртовий розчин нітрогліцерину використовують як ліки при захворюваннях серця (розширює кровоносні судини).
1 Назви “нітрогліцерин”, а також “динітрогліколь”, що склалися історично, неточні: у нітросполуках нітрогрупа безпосередньо сполучена з вуглецевим атомом (див. § 18.1).