Насичені одноатомні спирти – Оксигеновмісні органічні сполуки
Хімія
Органічна хімія
Оксигеновмісні органічні сполуки
Насичені одноатомні спирти
Спирти – це органічні сполуки, до складу яких входить одна або декілька гідроксильних груп (гідроксигруп), сполучених з вуглеводневим радикалом.
Гідроксигрупа  називається функціональною групоЮ, оскільки вона зумовлює основні хімічні властивості спиртів.
називається функціональною групоЮ, оскільки вона зумовлює основні хімічні властивості спиртів.
У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від
Представники гомологічного ряду насичених одноатомних спиртів
| Молекулярна формула | Назва за міжнародною систематичною номенклатурою | Тривіальна назва |
| Метанол | Метиловий спирт | |
| Етанол | Етиловий спирт | |
| Пропанол | Пропіловий спирт | |
| Бутанол | Бутиловий спирт | |
| Пентанол | Аміловий спирт |
Загальна формула насичених одноатомних спиртів: 
 , де R – вуглеводневий радикал, або
, де R – вуглеводневий радикал, або  .
.Ізомерія спиртів зумовлена будовою карбонового скелета й положенням функціональної групи.
При складанні назви ізомеру нумерація атомів Карбону починається з того кінця карбон-карбонового ланцюга, до якого ближча функціональна група. Номер атома Карбону, при якому знаходиться гідроксигрупа, указується в кінці назви спирту. Положення вуглеводневого радикала вказується на початку назви. Наприклад:

4-метилпентанол-2 (але не 2-метилпентанол-4)
Фізичні властивості спиртів. Спирти з числом атомів Карбону до 15 – рідини, інші – тверді речовини. Метанол і етанол – безбарвні рідини, з характерним запахом, добре розчинні у воді. Температура плавлення метанолу –
 , етанолу –
, етанолу –  . Температура кипіння метанолу –
. Температура кипіння метанолу –  , етанолу –
, етанолу –  .
.Біологічна дія спиртів.
Метанол – дуже сильна отрута, якщо потрапляє в організм у малих дозах (5-10 мл), викликає сліпоту, у великих (30 мл) – смерть.
Етанол – наркотична речовина, у невеликих дозах викликає сп’яніння, у великих – смерть. При постійному вживанні етанолу розвивається захворювання – алкоголізм.
Добування спиртів.
1) Приєднання води до алкенів (гідратація):
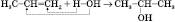
або

2) Із галогенопохідних:
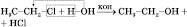
або
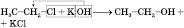
3) Каталітичний синтез метанолу з карбон(ІІ) оксиду і Гідрогену за температури близько
 , тиску 7 МПа, каталізатор – суміш цинк оксиду і купрум(II) оксиду:
, тиску 7 МПа, каталізатор – суміш цинк оксиду і купрум(II) оксиду:
4) Етанол утворюється в результаті бродіння глюкози:

Хімічні властивості спиртів (на прикладі етанолу).
1) Горіння:

Утворюються вуглекислий газ і вода (при достатній кількості кисню). Реакція проходить із великим виділенням теплоти.
2) Взаємодія з активними металами:

Утворюються водень і алкоголяти (у даному випадку – калій етилат).
3) Взаємодія з галогеноводнями:

4) Внутрішньомолекулярна дегідратація (за температури, що перевищує
 у присутності концентрованої сульфатної кислоти):
у присутності концентрованої сульфатної кислоти):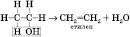
5) Міжмолекулярна дегідратація (при надлишку спирту і температурі, що не перевищує
 ):
):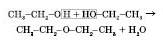
діетиловий естер
Діетиловий естер належить до простих естерів із загальною формулою,
 , де
, де  і
і  – вуглеводневі радикали спиртів.
– вуглеводневі радикали спиртів.Застосування спиртів.
Етанол Застосовують для добування синтетичного каучуку, пластмас, різних органічних речовин: діетилового естеру, барвників, оцтової кислоти. Його використовують як розчинник для виготовлення парфумів, одеколонів, ліків, лаків і т. д. Етанол у суміші з бензином можна використовувати як пальне для двигунів внутрішнього згоряння.
Метанол Застосовують як розчинник або сировину для одержання формальдегіду, деяких барвників, фотореактивів, фармацевтичних препаратів.