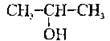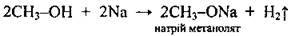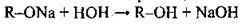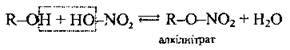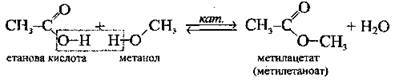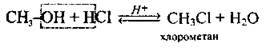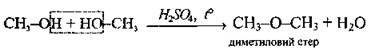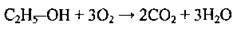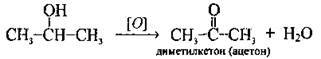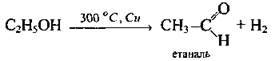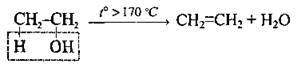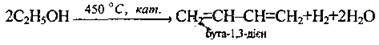Насичені одноатомні спирти – Спирти – Оксигеновмісні органічні сполуки
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ
12. Оксигеновмісні органічні сполуки
12.1. Спирти
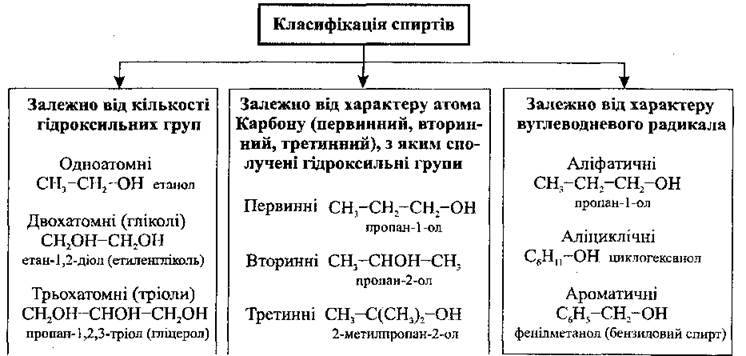
Спирти (алканоли, алкоголі) – це похідні вуглеводнів, у молекулах яких один або декілька атомів Гідрогену заміщені гідроксильною групою – ОН. Спирти – великий і різноманітний клас органічних сполук, вони широко розповсюджені в природі, мають важливе промислове значення.
У первинних, вторинних і третинних спиртів гідроксил розміщений відповідно
12.1.1. Насичені одноатомні спирти
Гомологічний ряд насичених одноатомних спиртів
Молекулярна формула спирту | Скорочена структурна формула спирту | Назва спирту | |
Міжнародна | Тривіальна (традиційна) | ||
СН3ОН | СН3-ОН | Метанол | Метиловий (мурашиний) спирт |
С2Н5ОН | СН3-СН2-ОН | Етанол | Етиловий спирт |
C3H7OH | СН3-СН2-СН2-ОН | Пропан-1-ол | Пропіловий |
| Пропан-2-ол | Ізопропіловий спирт |
Номенклатура насичених одноатомних спиртів
1. Назву одноатомного насиченого спирту нерозгалуженої будови утворюють від назви відповідного алкану шляхом додавання до нього локанту, біля якого розміщена гідроксильна група, і суфікса – ол, які відокремлюють один від одного дефісами:
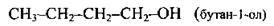
2. При утворенні назв спиртів розгалуженої будови вибирають найдовший карбоновий ланцюг, що містить:
А) гідроксильну групу;
Б) найбільшу кількість розгалужень:
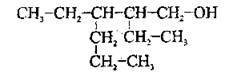
3. Нумерацію атомів Карбону проводять таким чином, щоб:
А) положення гідроксильної групи було позначено найменшим локантом;
Б) якщо гідроксильна група рівновіддалена від обох кінців ланцюга, беруть до уваги положення алкільного замісника (принцип найменших локантів):
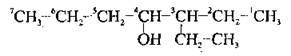
В) якщо і гідроксильна група, і алкільні замісники рівновіддалені від обох кінців ланцюга, керуються алфавітним принципом:
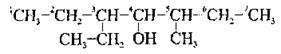
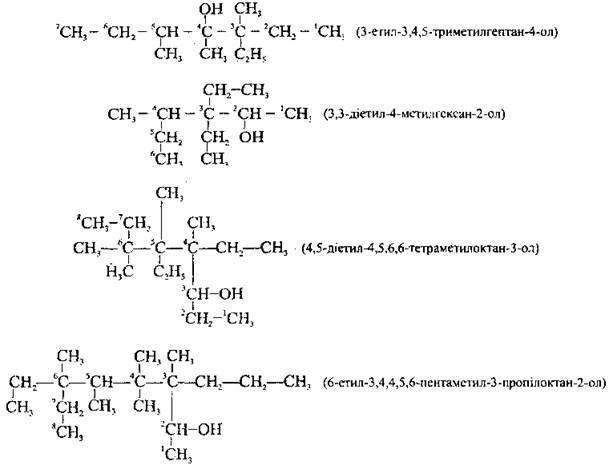
4. Назву одноатомного насиченого спирту розгалуженої будови становлять:
А) локанти і назви алкільних замісників (відділених один від одного дефісами);
Б) назва відповідного алкану (з назвою останнього алкільного замісника пишеться разом);
В) локант, біля якого розміщена гідроксильна група, і суфікс – ол, що відокремлюють один від одного дефісами.
Наприклад:
Властивості насичених одноатомних спиртів
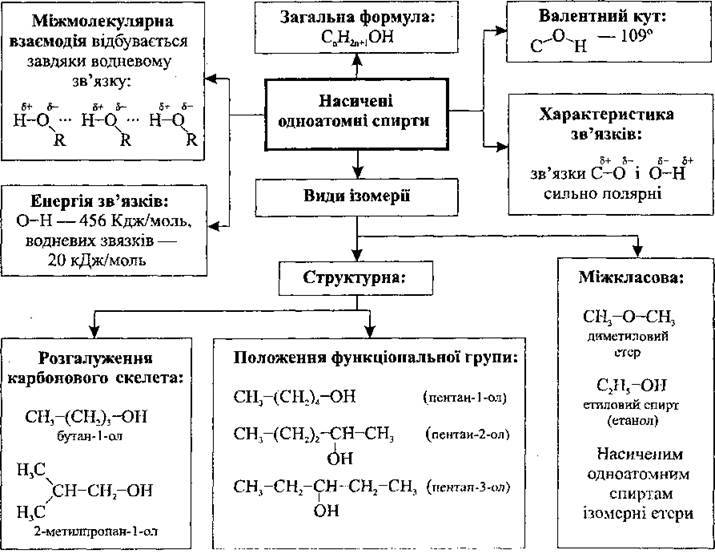
Молекулу спирту можна розглядати і як похідну води, у молекулі якої один атом Гідрогену заміщений на алкільний замісник. Через наявність водневих зв’язків спирти (як і вода) мають аномально високу густину, температури плавлення і кипіння.
Одноатомні спирти з кількістю атомів Карбону від 1 до 10 є рідинами1, а від 11 і вище – тверді кристалічні речовини. Серед спиртів, на відміну від вуглеводнів, немає газоподібних речовин. Відповідно, температури плавлення і кипіння спиртів значно вищі, ніж у вуглеводнів. Це пов’язано із наявністю міжмолекулярного водневого зв’язку (його енергія – 20 кДж/моль).
Нижчі спирти – метанол, етанол – безбарвні, зі специфічним “спиртовим” запахом, необмежено розчинні у воді та органічних розчинниках. Зі збільшенням молярної маси у гомологічному ряду зростає гідрофобність.
Хімічні властивості спиртів насамперед зумовлені наявністю полярної функціональної групи – ОН. Гідроксильний Оксиген перебуває у стані sp3-гібридизації. На ньому (як на найбільш електронегативному елементі) зосереджений частковий негативний заряд δ-, а на гідроксильному атомі Гідрогену – частковий позитивний заряд δ+ (Alk – алкільний замісник):
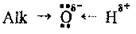
Реакції з розривом зв’язку О-Н | ||||
З активними металами (К, Na, Mg, Al) |
Алканоляти легко розкладаються водою:
| Реакція заміщення. Утворюються алкоголяти (алканоляти) | ||
З мінеральними кислотами |
| |||
З органічними кислотами; каталізатор – мінеральна кислота |
| Реакція естерифікації. Утворюються естери | ||
Реакції з розривом зв’язку С-О | ||||
З галогеноводнями |
| Реакція заміщення. Проводиться за допомогою реактиву Лукаса (HCl + ZnCl2) | ||
Міжмолекулярна дегідратація |
| T= 130-140 °С | ||
Реакції за участі групи – ОН і атома Гідрогену, який розміщений біля сусіднього атома Карбону | ||||
Повне |
| Горіння | ||
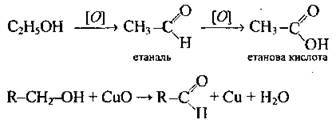
Окиснення | Неповне | Первинних спиртів |
| Відбувається під дією КМnO4, К2Сr2O7, кисню повітря (за наявності каталізатора Cu) та ін. |
Вторинних спиртів |
| |||
Відщеплення | H2 |
| Дегідрування | |
Н2O |
| Внутрішньо-молекулярна дегідратація (у присутностіH2SO4 або Аl2O3) | ||
Н2 та Н2O |
| Одночасна дегідратація і дегідрогенізація | ||
Унаслідок цього цей атом Гідрогену стає хімічно активним і може заміщуватись на атоми активних металічних елементів (як і в молекулах води і кислот). Таким чином спирти виявляють кислотні властивості.
З другого боку, в атома Оксигену є дві неподілені електронні пари, внаслідок чого він може приєднувати йони Н+. Отже, спирти виявляють і основні властивості (амфотерність).
Зауважимо, що і кислотні, і основні властивості виражено в спиртів дуже слабо. Водні розчини перших трьох членів гомологічного ряду насичених одноатомних спиртів є нейтральними і не змінюють кольору індикаторів (вищі спирти у воді не розчиняються).
Добування насичених одноатомних спиртів
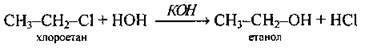
1. Гідроліз моногалогеноалканів під дією водних розчинів лугів:
2. Окиснення насичених вуглеводнів:
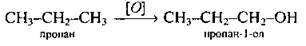
3. Гідратація алкенів (відбувається за правилом Марковникова):
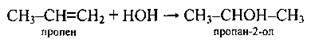
4. Відновлення альдегідів (а також кетонів, карбонових кислот, естерів):
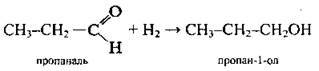
5. Метанол добувають такими методами:
А) у процесі сухої перегонки деревини, тому одна з тривіальних назв метанолу – деревний спирт (найдавніший метод, на сьогодні втратив своє значення);
Б) із синтез-газу (суміші, яка містить СО та Н2):
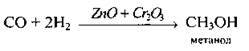
6. Етанол добувають:
А) гідратацією етену:
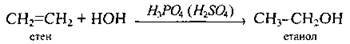
Б) спиртовим бродінням цукристих речовин (так одержують етанол – винний спирт):
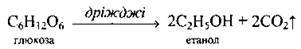
В) гідролізом клітковини (целюлози) і подальшим бродінням продуктів гідролізу (гідролізний спирт):
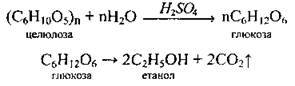
Застосування одноатомних спиртів
Етанол використовують:
– у харчовій промисловості для виготовлення алкогольних напоїв;
– як розчинник, екстрагент (w – мінімум 18 %) і консервант для виготовлення та зберігання фармацевтичних препаратів, косметичних засобів тощо;
– у медицині для дезінфекції шкіри як бактерицидний засіб (використовують 70 %-вий, так званий медичний спирт; особливість дії речовини саме такої концентрації полягає в тому, що зберігаються потужні бактерицидні властивості, але при цьому спирт не коагулює білків зовнішньої мембрани і мікроорганізми не утворюють захисної оболонки, цисти), також для компресів;
– у виробництві хлороформу, оцтової кислоти, бутадієнового каучуку.
Метанол використовують в органічному синтезі як розчинник. З нього виготовляють мурашиний альдегід (формальдегід, сировину для виробництва фенол-формальдегідних смол).
____________________________________________________________________
1 Одноатомні спирти з кількістю атомів Карбону від 3 і вище називають сивушними маслами. Це побічний продукт спиртового бродіння рослинних вуглеводів (крім спиртів, може містити альдегіди, жирні кислоти, фурфурол), токсичний, має різкий неприємний запах і залежно від складу – колір від світло-жовтого до бурого.